题目内容
【题目】硅在集成电路中应用十分广泛,如图是元素在元素周期表中的相关信息及硅原子的结构示意图。下列说法错误的是
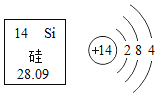
A.硅原子核内中子数为14
B.硅元素位于元素周期表的第三周期
C.硅原子在化学反应中既不易失电子,也不易得电子
D.硅是地壳中含量最高的非金属元素
【答案】D
【解析】
A、根据元素周期表中的一格可知,左上角的数字为表示原子序数;根据原子中原子序数=核电荷数=质子数=核外电子数,则该元素的原子核内质子数为14 ,相对原子质量约等于28,则中子数=28-14= 14 ,故选项说法正确。
B、硅原子核外有三个电子层,故硅元素位于元素周期表的第三周期,正确。
C、硅原子最外层电子数为4,在化学反应中既不易失电子,也不易得电子,正确。
D、地壳中含量最高的非金属元素是氧元素,不是硅元素,选项错误。
故选:D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
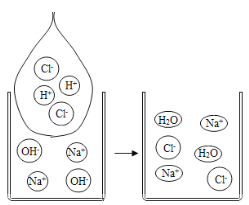
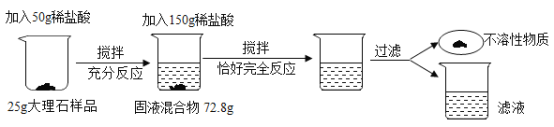
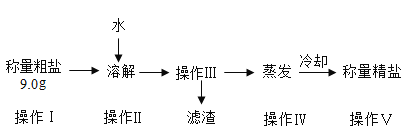
小学生10分钟应用题系列答案【题目】某小组同学欲提纯粗盐(只含氯化钠和少量泥沙)样品,实验过程和氯化钠的溶解度数据如下。
温度(°C) | 10 | 20 | 30 | 40 | 60 |
溶解度/g/100g水 | 35.8 | 36.0 | 36.1 | 36.4 | 37.1 |
(1)30°C时氯化钠的溶解度是______________。
(2)操作Ⅲ的名称是______________,其原理是依据_____________的性质进行提纯。
(3)最终提纯所得精盐质量偏少,可能的原因是______________ (选填编号)。
a 操作II中食盐未完全溶解就进行操作Ⅲ
b 操作Ⅲ中有滤渣漏入承接液体的烧杯
c 操作II、IV实验过程中有物质溅出
d 操作IV蒸发最终所得精盐比较潮湿
(4)溶解粗盐时,加入20°C水合适的量约为_____________(选填“20”、“30” 或“50”) mL。
(5)称取4.5g提纯的精盐,可配制质量分数为0.9%的食盐溶液______________g。
【题目】溶液与人们的生活息息相关。
(1)下列少量物质分别放入水中,充分搅拌,可以得到溶液的是______(填字母).
A 高锰酸钾
B 汽油
C 面粉
(2)在盛有水的烧杯中加入以下物质,能使溶液温度升高的是____(填字母)。
A 烧碱
B 硝酸铵
C 氯化钠
(3)下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/°C | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
氢氧化钙 | 0.9 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①60°C时,氯化钠的溶解度_______。
②表中某物质的饱和溶液随温度升高析出固体,该物质是____(填化学式)
③20°C时,氯化钠饱和溶液中溶质的质量分数为_____(结果保留至0.1%) .
④向20°C的氢氧化钙饱和溶液中加入少量生石灰,再冷却至20°C,此时溶液中溶质的质量比加入生石灰前溶液中溶质的质量___ (填 “增大”“不变”或“减小”)。
⑤用_____的方法提纯混有少量氯化钠的硝酸钾固体.
【题目】2020年我国在部分地区和领域禁塑限塑。化学杜团同学对平常在超市买东西时带回来的塑料袋进行探究。
[查阅资料]日常生活中使用的塑料袋有用聚乙烯制成的,也有用聚氯乙烯制成的。聚乙烯燃烧生成CO2和H2O;聚氯乙烯燃烧除了生成CO2和H2O之外,还会有HCl气体产生;无水氯化钙可用作干燥剂。
探究一、该塑料袋的材料是什么
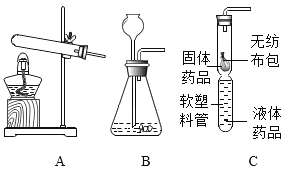
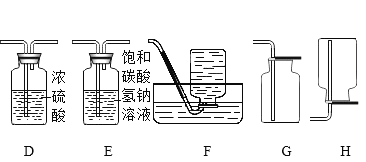
[实验]小明将该塑料袋样品在氧气中燃烧的产物通入下图一的装置进行探究。
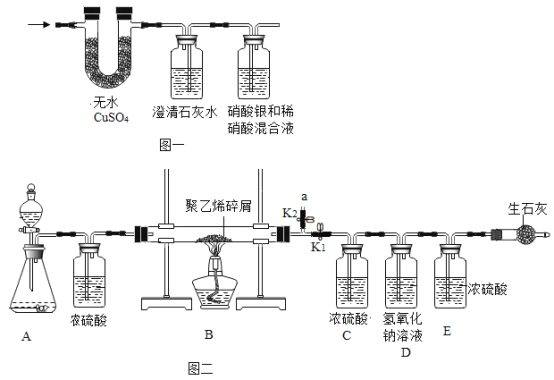
[质疑]李蕾认为小明设计的装置无法得出正确的结论,他的依据是______________。经完善装置,确认该塑料袋的材料是聚乙烯。
探究二、探究聚乙烯的组成碎屑
[实验设计]小组同学设计上图二所示装置。
[分析] A装置是氧气发生装置,反应原理为________________(用化学方程式表示)。
[实验操作]称取5.6g样品碎屑于B处硬质玻璃管中,排出装置中空气后,通入足量的氧气使样品充分燃烧,并将产生的气体通入足量的浓硫酸和氢氧化钠溶液中。
[数据记录]实验结果:
样品燃烧前 | 样品燃烧后 | |
C装置的质量/g | 213.6 | 220.8 |
D. E装置的总质量/g | 440.2 | 457.8 |
[分析与结论]聚乙烯中____________(填“含”或“不含”氧元素,聚乙烯中碳元素,氢元素的质量比为______。
[反思]如果没有E装置,对所测碳元素的质量的影响是___ (填 “偏大”“无影响”或“偏小”)。