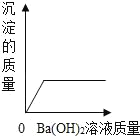
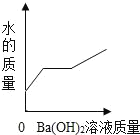
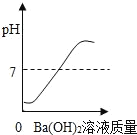
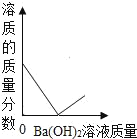
题目内容
【题目】金属M的样品中含有不跟盐酸反应的杂质,取样品20克投入适量的盐酸恰好完全反应,生成MCl3和2克H2,测知MCl3中含有Cl的质量分数为79.8%,则样品中M的质量分数约为( )![]()
A.90%B.10%C.45%D.54%
【答案】A
【解析】
已知样品的质量,要计算样品中金属M的质量分数,需要计算出金属M的质量,根据金属与盐酸反应生成MCl3和2克H2,氢元素与氯元素来自于氯化氢,由氢元素质量计算出氯元素的质量,再利用已知条件MCl3中含有Cl的质量分数为79.8%,由氯元素的质量计算M的质量即可。
根据以上分析,在氯化氢中,氢元素与氯元素的质量比为1:35.5,已知反应生成2克H2,则氯元素的质量为![]() ,MCl3中含有Cl的质量分数为79.8%,则MCl3的质量为
,MCl3中含有Cl的质量分数为79.8%,则MCl3的质量为![]() ;则金属M 的质量为
;则金属M 的质量为![]() ;则样品中M的质量分数为
;则样品中M的质量分数为![]() ;A选项正确,符合题意。故选A。
;A选项正确,符合题意。故选A。

 阅读快车系列答案
阅读快车系列答案【题目】有一包固体粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠中的四种物质。某兴趣小组为确定其组成设计并进行如下实验。
(实验一)甲组同学进行如下探究。请完成表中空白。
实验操作 | 实验现象 | 实验结论及分析 |
Ⅰ.取少量该固体粉末于烧杯中,加入足量的水溶解、过滤 | 粉末部分溶解,得到白色滤渣和无色滤液 | 滤渣中一定含有_____ |
Ⅱ.向滤液中滴加无色酚酞试液 | 溶液变红 | 滤液中可能含有_____物质(填“酸性”“碱性”或“中性”) |
Ⅲ.向Ⅱ中所得溶液滴加足量稀盐酸 | _____ | 原固体粉末中一定含有Na2CO3 |
(实验二)乙组同学进行如下探究。
取21.0g该固体粉末,加入160.0g 10%的稀盐酸,恰好完全反应,实验测得产生8.8g二氧化碳,将反应后溶液继续蒸发结晶,得到固体,测定所得固体中含16.0g氯元素。
试综合甲、乙两组同学的实验进行分析,填空:
(1)乙组实验中一定发生的化学反应是:Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)固体粉末的组成中除Na2CO3外,一定还含有的物质是_____,可能含有的物质是_____(均填写化学式)
【题目】(提出问题)木炭与CuO反应所得红色固体中含有什么物质?
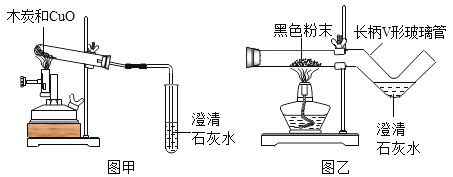
(查阅资料)(1)木炭与CuO的反应是:C+2CuO![]() 2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
(2)Cu2O是红色固体,能与稀硫酸反应:Cu2O+H2SO4═Cu+CuSO4+H2O
(作出猜想)红色固体的成分:①全部是Cu;②全部是Cu2O;③______.
(实验探究)(1)取木炭、CuO两种黑色粉末适量,再也少许CaC12(能降低反应温度,加快反应速率)均匀混合,然后将黑色粉末装入长柄V形玻璃管的直管内.
(2)按图乙连好实验装置,然后加热反应物;2分钟后,黑色粉末出现红热现象,同时澄清的石灰水_,此时停止加热.
(3)待玻璃管冷却后,提取里面的红色固体,进行如下的验证:
步骤 | 现象 | 结论 |
①取1.44g红色固体装入试管,滴入足量的_____,充分反应 | 红色固体部分减少,溶为变为___色 | 猜想___错误 |
②滤了试管中残留的红色固体,洗涤干燥,称其质量为1.04g | 猜想___正确 |
(评价反思)
(1)使用图乙装置与使用图甲装置相比,其优点是_____(写出1条即可).
(2)若要证明CaC12是该反应的催化剂,还需要验证CaCl2的_____.
(3)在铜的冶炼史中,我国劳动人民还有一项重大发明就是“湿法炼铜”,该方法可用化学方程式表示为___.