题目内容
(9分)请你参与某学习小组进行研究性学习的过程,并协助完成相关任务:
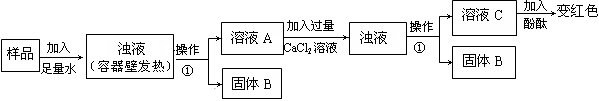
【研究课题】:探究热水壶底部水垢的主要成分
【查阅资料】:该小组同学通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热时,这些离子趋于生成溶解度更小的物质—水垢(主要成分为碳酸盐、碱等的混合物)。同时,他们还查阅到下列有关物质的溶解性:
【提出猜想】:水垢的主要成分一定含有CaCO3和 ,可能含有Ca(OH)2和 。写出Ca(HCO3)2受热分解的化学方程式 。
【设计方案】:
⑴ 甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液加入 ,没有白色沉淀,说明水垢中无Ca(OH)2;
⑵ 乙同学设计下列实验装置,进一步确定水垢中含有碳酸盐的成分,步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,加入足量某酸溶液;
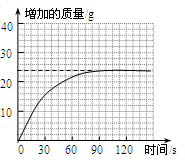
②测量一定时间内干燥管内物质增加的质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变。
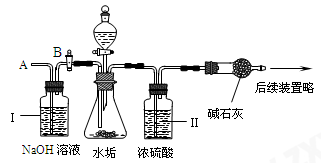
a.步骤①所加的酸溶液是 。
b.装置Ⅱ的作用是 ;
从导管A处缓缓鼓入一定量的空气的作用是____________________。
c.研究性小组的同学通过简单计算,认为水垢中一定含有MgCO3,理由是 。
【实验结论】通过上述探究可知:水垢的主要成分有 。
【研究课题】:探究热水壶底部水垢的主要成分
【查阅资料】:该小组同学通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热时,这些离子趋于生成溶解度更小的物质—水垢(主要成分为碳酸盐、碱等的混合物)。同时,他们还查阅到下列有关物质的溶解性:
| 物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
【设计方案】:
⑴ 甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液加入 ,没有白色沉淀,说明水垢中无Ca(OH)2;
⑵ 乙同学设计下列实验装置,进一步确定水垢中含有碳酸盐的成分,步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,加入足量某酸溶液;
②测量一定时间内干燥管内物质增加的质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变。


a.步骤①所加的酸溶液是 。
b.装置Ⅱ的作用是 ;
从导管A处缓缓鼓入一定量的空气的作用是____________________。
c.研究性小组的同学通过简单计算,认为水垢中一定含有MgCO3,理由是 。
【实验结论】通过上述探究可知:水垢的主要成分有 。
【提出猜想】Mg(OH)2(1分) MgCO3; Ca(HCO3)2= CaCO3+ CO2↑+ H2O
【设计方案】
⑴ Na2CO3溶液;
⑵ a.稀盐酸;
b.吸收CO2中的水; 使装置中的二氧化碳全部被碱石灰吸收
c.即使50g水垢全部为CaCO3,产生CO2的质量应为22g,而实验测得生成的CO2质量>22g
【实验结论】Mg(OH)2、CaCO3、MgCO3
【设计方案】
⑴ Na2CO3溶液;
⑵ a.稀盐酸;
b.吸收CO2中的水; 使装置中的二氧化碳全部被碱石灰吸收
c.即使50g水垢全部为CaCO3,产生CO2的质量应为22g,而实验测得生成的CO2质量>22g
【实验结论】Mg(OH)2、CaCO3、MgCO3
试题分析:【提出猜想】根据题意可知,水垢的主要成分为碳酸盐、碱等物质的混合物,再结合物质的溶解性表可知,水垢中一定含Mg(OH)2和CaCO3,可能含有Ca(OH)2和MgCO3;Ca(HCO3)2受热分解生成碳酸钙、水和二氧化碳,故反应的化学方程式为Ca(HCO3)2 加热 CaCO3+CO2↑+H2O。
【设计方案】
(1)检验Ca2+要用可溶性的碳酸盐,如Na2CO3溶液,因为二者能反应产生沉淀。
(2)a.由于水垢中存在有碳酸钙,而硫酸与碳酸钙反应会生成微溶于水的硫酸钙,覆盖在碳酸钙的表面,阻止了反应的进一步进行,故溶解碳酸盐一般用稀盐酸;
b.因为该实验是要通过测定生成二氧化碳的质量来确定水垢的成分,而从锥形瓶中出来的二氧化碳气体是不干燥的,且都会被干燥管内的物质吸收,从而影响到结果的测定,所以二氧化碳气体在进入干燥管之前必须经过干燥,浓硫酸恰可以用来干燥二氧化碳气体;由于气压的原因,最后锥形瓶中会残存有一定量的二氧化碳气体,故从导管A处缓缓鼓入一定量的空气吗,可以使装置中的所有二氧化碳都能被碱石灰所吸收。
c.根据化学方程式的计算可知,即使50g水垢全部为CaCO3,产生CO2的质量也仅为22g,而实验测得生成的CO2质量为24g,比22g多,所以水垢中一定还有MgCO3。
【实验结论】实验猜想中已经确定有Mg(OH)2和 CaCO3,而根据(2)的计算可知还应该含有MgCO3,故水垢的主要成分有Mg(OH)2、CaCO3和MgCO3。32-检验方法),二氧化碳的化学性质,酸的物理性质及用途,碱的化学性质
点评:在解此类题时,首先要会分析题中所涉及的反应原理,然后结合反应原理和计算所要用到的数据进行分析解答。对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目


 时间/s
时间/s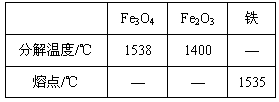
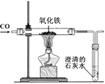
 (燃烧匙中的药品为红磷)
(燃烧匙中的药品为红磷)