题目内容
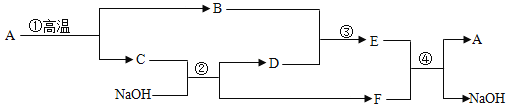
【题目】钢铁是重要的金属材料,在生产、生活中有广泛的用途。建造北京奥运会主体育场“鸟巢”,就是用了大量的钢铁。
(1)某“取暖片”外包装的图片。该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,打开包装后即会缓慢放出热量。
①其发热原理是_____。
②推测发热剂成分中氯化钠的作用是_____。
(2)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,请写出最后炼铁的化学方程式:_____
(3)硅酸盐是构成地壳岩石的主要成分。化学上常用二氧化硅和氧化物的形式表示其组成。例如:镁橄榄石(Mg2SiO4)常以2MgO·SiO2表示。依照上法表示下列硅酸盐的组成:
高岭石Al2(Si2O5)(OH)4_____。滑石Mg3(Si4O10)(OH)2_____。
【答案】铁生锈缓慢氧化放出热量 加快铁生锈  Al2O32SiO22H2O 3MgO4SiO2H2O
Al2O32SiO22H2O 3MgO4SiO2H2O
【解析】
(1)“取暖片”中有铁粉、活性炭、氯化钠、水等,打开包装后,铁粉发生缓慢氧化放出热量。 ①故其发热原理是铁生锈缓慢氧化放出热量。②铁生锈是铁与氧气、水发生一系列复杂的化学变化,发热剂成分中氯化钠的作用是加快铁生锈。
(2)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,炼铁时是以一氧化碳为还原剂,最后炼铁的化学方程式:
(3)硅酸盐常用二氧化硅和氧化物的形式表示,依据物质的化学式中各种原子个数相等,
高岭石Al2(Si2O5)(OH)4可表示为Al2O32SiO22H2O。滑石Mg3(Si4O10)(OH)2可表示为3MgO4SiO2H2O。

 阅读快车系列答案
阅读快车系列答案【题目】某品牌可乐由水、白砂糖、焦糖色素(使可乐显黑褐色)、磷酸(H3PO4)等,按一定比例混合并压入二氧化碳配制而成。某同学为了探究可乐的成分及其含量,进行如下实验。
实验一 可乐中二氧化碳的定性检验
(1)请完成下表:
实验步骤 | 实验现象 | 结论 |
打开一塑料瓶装可乐,塞上带导管的橡胶塞,把导管插入 (填化学式)溶液中 | 观察到 | 可乐中含有二氧化碳 |
实验二 可乐中磷酸的定量测定
测定过程如下:
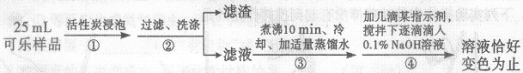
(2)步骤①用活性炭浸泡的目的是 。
(3)步骤③煮沸10分钟的目的是除尽滤液中的 。
(4)已知步骤④反应的化学方程式为H3PO4+NaOH=NaH2PO4+H2O,测得共消耗0.1%的NaOH溶液20g,忽略可乐中其它成分对测定结果的影响,计算可乐中磷酸的含量(以g/L为单位。相对分子质量:H3PO4—98;NaOH—40),写出计算过程。
(5)如果步骤②缺少洗涤,则测定结果 (填“偏高”“不变”或“偏低”)。