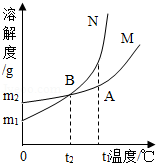
题目内容
【题目】同学们利用“硫酸硝酸铵、氢氧化钠、碳酸钾四种物质的溶液进行探究学习,请你们一起完成下列问题:
(实验探究)A、B、C、D四组同学分别进行了下列实验。
氢氧化钠溶液 碳酸钾溶液 硝酸钡溶液 碳酸钾溶液

(1)写出A中反应的化学方程式_____;
(挖掘实质)如图是A组反应的微观过程示意图。
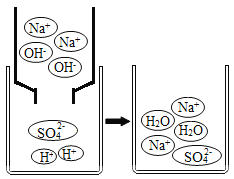
(2)该反应的实质可以用化学符号表示为_____;
(实践运用)完成试验后,四组同学将废液倒入同一个烧杯中,再将废液过滤,得到无色溶液和白色沉淀,向无色溶液滴加紫色石蕊试剂,变为红色。
(3)溶液中的白色沉淀一定是_____,理由是_____。
(4)从反应的试剂可以分析,废液中一定不含有的离子是_____;
(5)为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证:
溶液中可能含有的离子 | 实验步骤 | 实验现象 | 实验结论 |
可能含有_____ | ②取滤液滴加_____ | 现象明显 | 含有该离子 |
【答案】2NaOH+H2SO4=Na2SO4+2H2O; H++OH-=H2O 硫酸钡 无色溶液滴加紫色石蕊试剂,变为红色,说明得到无色溶液为酸性,酸过量,说明白色沉淀不能溶于酸 OH-和CO32- 可能含有Ba2+(或SO42-) 硫酸钠(或硝酸钡)
【解析】
(1)A中的反应氢氧化钠和硫酸反应生成硫酸钠和水,方程式为2NaOH+H2SO4=Na2SO4+2H2O;
(2)A组的反应属于酸、碱中和反应,实质是H++OH-=H2O;
(3)无色溶液滴加紫色石蕊试剂,变为红色,说明得到无色溶液为酸性,酸过量,亦说明白色沉淀不能溶于酸,由“硫酸、硝酸铵、氢氧化钠、碳酸钾”四种物质看,沉淀一定是硫酸钡;
(4)氢氧根离子和碳酸根离子不能与氢离子共存。由于无色溶液滴加紫色石蕊试剂,变为红色,说明得到无色溶液为酸性,酸过量,则溶液中一定不能含有OH-和CO32-;
(5)通过上述探究发现,在溶液中H+和OH-不能大量共存,在溶液中Ba2+和SO42-也不能大量共存;利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.经测定,该溶液显酸性.则在该溶液中一定含有的离子是H+、Na+、K+和NO3-,可能存在Ba2+或SO42-。因此:
溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
可能性一:Ba2+(同时答两种或两种以上离子的不得分,下同) | 取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+. |
可能性二:SO42- | 取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. |

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】下列知识归纳,完全正确的一组是
A、能量变化 | B、环境保护 |
①电解水是将电能转化成化学能 ②煤燃烧是将化学能转化成热能 ③在化学反应中只有燃烧才能放出热量 | ①小区设置废旧电池回收箱 ②重复使用塑料袋和塑料盒 ③工业“三废”处理达标后排放 |
C、数字含义 | D、资源节约 |
①Fe2+:一个亚铁离子带2个单位正电荷 ②SO3:一个三氧化硫分子中含有3个原子 ③ | ①废旧金属回收利用 ②提倡使用乙醇汽油 ③实验后用剩药品放回原瓶 |
A.AB.BC.CD.D