题目内容
【题目】下列说法中,正确的是( )
A.![]() 溶液能使无色酚酞溶液变红色,可知
溶液能使无色酚酞溶液变红色,可知![]() 属于碱类
属于碱类
B.由![]() 可知,CO在此反应中是氧化剂
可知,CO在此反应中是氧化剂
C.某固体氮肥与熟石灰混合、研磨产生氨味则该氮肥一定是铵态氮肥
D.某物质在氧气中完全燃烧生成![]() 和
和![]() ,则该物质一定含有C、H、O元素
,则该物质一定含有C、H、O元素
【答案】C
【解析】
A、根据盐的化学性质,进行分析判断。
B、根据一氧化碳夺取了氧化铜中的氧,进行分析判断。
C、铵态氮肥与碱性物质混合研磨后能放出有刺激性气味的气体,进行分析判断。
D、根据质量守恒定律,反应前后元素种类不变,进行分析判断。
A、Na2CO3溶液能使无色酚酞溶液变红色,但Na2CO3是由钠离子和碳酸根离子构成的化合物,属于盐类,故选项说法错误。
B、由![]() 可知,一氧化碳夺取了氧化铜中的氧,具有还原性,是还原剂,故选项说法错误。
可知,一氧化碳夺取了氧化铜中的氧,具有还原性,是还原剂,故选项说法错误。
C、铵态氮肥与碱性物质混合研磨后能放出有刺激性气味的气体,某固体氮肥与熟石灰混合、研磨产生氨味,则该氮肥一定是铵态氮肥,故选项说法正确。
D、某物质在氧气中完全燃烧生成H2O和CO2,CO2和H2O两种物质中含有碳、氢、氧三种元素,根据质量守恒定律,反应前后,元素种类不变,反应物氧气中只含有氧元素,则某化合物中一定含有碳、氢两种元素,可能含有氧元素,故选项说法错误。
故选:C。

【题目】小红同学进行酸碱中和反应的实验(如图所示)。她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂。为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中液体颜色没有变化。于是她对烧杯中的溶液进行了以下探究:

(1)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应;②氢氧化钠有剩余;③盐酸有剩余
小明同学却判定不可能“氢氧化钠有剩余”,他的理由是 。
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证。请根据相关内容填写下表:
实验方法 | 可能观察到的现象 | 结论 |
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中 | 如果 | 则盐酸过量 |
如果 | 则盐酸与氢氧化钠恰好完全反应 |
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的,你认为其中不正确的是 (填序号)。
A.生锈的铁钉 B.碳酸钠粉末 C.硫酸钠粉末 D.氢氧化铜
(4)下列曲线能够表示小红所做实验中溶液pH变化趋势的是 (填序号)。

【题目】网络上有一段视频:将“锡纸”剪成一段两头宽中间窄的纸条,然后两头分别连接电池的正负极,观察到“锡纸”立即燃烧。据此,小力同学取某种“锡纸”进行了以下探究:
(1)探究“锡纸”燃烧的原因:“锡纸”两端连接电池两极后造成短路致使“锡纸”燃烧,从燃烧的条件开始“锡纸”不燃烧但短路后却能燃烧的原因是_____________
(2)探究“锡纸”中金属的成分:
(查阅资料)①“锡纸”是锡箔或铝箔;②锌粉是一种深灰色固体;③锡(Sn)与酸或盐溶液反应生成正二价的锡盐。
(提出猜想)猜想I:“锡纸”中的金属是锡;
猜想I I:“锡纸”中的金属是铝。
(进行实验)设计方案并进行实验
实验操作 | 实验现象 | 实验分析与结论 |
取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液 | “锡纸”表面有深灰色固体析出 |
根据实验现象,结合金属活动性顺序可知猜想______________(填“I”或"II")成立;反应的化学方程式为______________________
(交流讨论)①实验中打磨“锡纸”的目的是_____________
②下列物质的溶液可以替代氯化锌溶液完成上述实验的是______________(序号)
A 硫酸铜 B 硝酸银 C 氯化钠 D 硫酸亚铁
(拓展应用)电器短路会引起火灾,我们要严加防范。如果电器着火应该采取的灭火方法是____.
【题目】同学们利用“硫酸硝酸铵、氢氧化钠、碳酸钾四种物质的溶液进行探究学习,请你们一起完成下列问题:
(实验探究)A、B、C、D四组同学分别进行了下列实验。
氢氧化钠溶液 碳酸钾溶液 硝酸钡溶液 碳酸钾溶液

(1)写出A中反应的化学方程式_____;
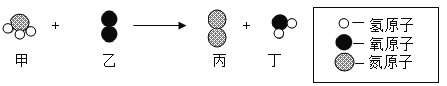
(挖掘实质)如图是A组反应的微观过程示意图。
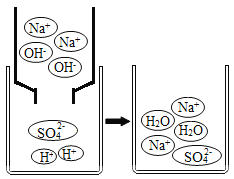
(2)该反应的实质可以用化学符号表示为_____;
(实践运用)完成试验后,四组同学将废液倒入同一个烧杯中,再将废液过滤,得到无色溶液和白色沉淀,向无色溶液滴加紫色石蕊试剂,变为红色。
(3)溶液中的白色沉淀一定是_____,理由是_____。
(4)从反应的试剂可以分析,废液中一定不含有的离子是_____;
(5)为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证:
溶液中可能含有的离子 | 实验步骤 | 实验现象 | 实验结论 |
可能含有_____ | ②取滤液滴加_____ | 现象明显 | 含有该离子 |