题目内容
【题目】根据下列装置图,回答有关问题:
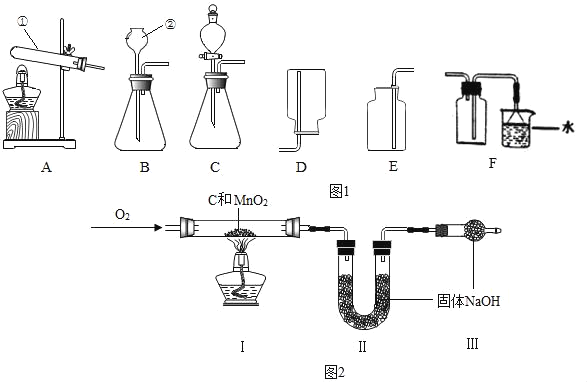
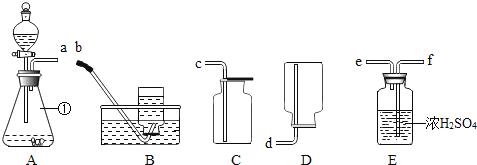
(1)写出图1中标号仪器的名称:①_____,②_____。
(2)实验室用高锰酸钾制氧气时发现水槽中水变红了,可能原因是_____。
(3)用双氧水制取氧气的化学方程式是_____,为得到平稳的氧气选用的发生装置是_____。用如图2装置从废旧干电池中回收MnO2并测定其含量,假设各步均完全反应,下列数据中可以计算样品中MnO2的含量的是_____。
a.反应前后氧气发生装置的质量
b.反应前后装置Ⅰ中固体的质量
c.反应前后装置Ⅱ中固体的质量
d.反应前后装置Ⅲ中固体的质量
(4)已知氨气是一种无色有刺激性气味的气体,密度比空气小,极易溶于水。实验室加热氯化铵和熟石灰固体制取并收集一瓶氨气,最佳的实验装置组合是_____。
(5)你认为实验室制取气体的反应,共同点是_____。
a.需要加热 b.反应物中没有气体参加
c.需要催化剂 d.反应物中必须含有要制取物质的元素。
【答案】试管 长颈漏斗 试管口没有放一团棉花 2H2O2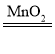 2H2O+O2↑ C b AF bd
2H2O+O2↑ C b AF bd
【解析】
(1)仪器①是试管,②是长颈漏斗。
(2)用高锰酸钾制氧气时,试管口未加一团棉花,高锰酸钾粉末进入从导管进入水槽中使水呈紫色。
(3)实验中,用双氧水与二氧化锰混合制取氧气的化学方程式是: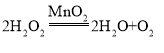 ;为得到平稳的氧气流选用的发生装置是C,因为C中的分液漏斗能够控制反应速率。
;为得到平稳的氧气流选用的发生装置是C,因为C中的分液漏斗能够控制反应速率。
a.知道反应前后氧气发生装置的质量,不能计算二氧化锰的含量。
b.反应前后装置Ⅰ中固体的质量差即为碳的质量,根据碳质量可以计算二氧化锰质量,进一步可以计算二氧化锰质量分数;
c.反应前后装置Ⅱ中固体的质量差即为反应生成二氧化碳质量,根据二氧化碳质量可以计算碳的质量,但是无法计算二氧化锰质量分数;
d.知道反应前后装置Ⅲ中固体的质量,不能计算二氧化锰的质量分数。
(4)实验室可以用加热氯化铵和熟石灰固体混合物的方法制取氨气,因此需要加热;氨气是一种无色有刺激性气味的气体,密度比空气小,极易溶于水,逸出污染空气,因此只能用F装置收集,F装置中只能从短管进入;故填:AF;
(5)反应不一定需要加热,如实验室制取二氧化碳是在常温下进行的;不一定需要催化剂,如实验室中制取氢气、二氧化碳等;实验室制取气体的反应,共同点是反应物中均没有气体参加,且反应物中必须含有要制取物质的元素;故填:bd。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案【题目】同学们利用“硫酸硝酸铵、氢氧化钠、碳酸钾四种物质的溶液进行探究学习,请你们一起完成下列问题:
(实验探究)A、B、C、D四组同学分别进行了下列实验。
氢氧化钠溶液 碳酸钾溶液 硝酸钡溶液 碳酸钾溶液

(1)写出A中反应的化学方程式_____;
(挖掘实质)如图是A组反应的微观过程示意图。
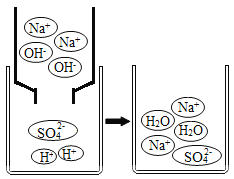
(2)该反应的实质可以用化学符号表示为_____;
(实践运用)完成试验后,四组同学将废液倒入同一个烧杯中,再将废液过滤,得到无色溶液和白色沉淀,向无色溶液滴加紫色石蕊试剂,变为红色。
(3)溶液中的白色沉淀一定是_____,理由是_____。
(4)从反应的试剂可以分析,废液中一定不含有的离子是_____;
(5)为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证:
溶液中可能含有的离子 | 实验步骤 | 实验现象 | 实验结论 |
可能含有_____ | ②取滤液滴加_____ | 现象明显 | 含有该离子 |