题目内容
某兴趣小组为探究“氧化铁和铜粉”混合物中铜的质量分数,称取一定质量的混合物,按照下图实验装置进行实验: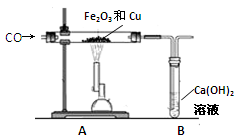
(1)实验时要“先通一氧化碳气体,后加热” 的目的是 。
(2)装置A中发生反应的方程式为 。
(3)实验装置B中的现象是 ,发生反应的化学方程式为 。
(4)该装置的设计有一明显不当之处,你的改进方案是 。
[定量分析]
该兴趣小组按照科学的方案完成实验后,对充分反应后的管内固体X进行如下后续实验探究: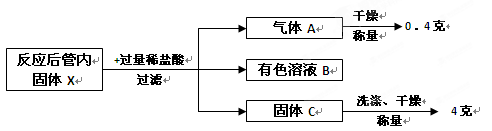
回答下列问题:
(1)写出固体X与稀盐酸反应的方程式: 。
(2)有色溶液B中含有的溶质: (填化学式)。
(3)根据以上实验流程,计算原混合物“氧化铁和铜粉”中铜的质量分数为 。
(1)排除试管内的空气,防止发生爆炸
(2)3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
(3)溶液变浑浊(或生成白色沉淀) Ca(OH)2+CO2=CaCO3↓+H2O
(4)将尾气点燃惧或收集
[定量分析]
(1)Fe+2HCl=FeCl2+H2↑
(2)FeCl2、HCl
(3)20%
解析试题分析:(1)实验时要“先通一氧化碳气体,后加热” 的目的是防止一氧化碳在试管中与空气混合被点燃而发生爆炸。
(2)一氧化碳会与氧化铁在高温的条件反应生成铁和二氧化碳,化学方程式为:3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
(3)因为在A中有二氧化碳气体生成,可使B中的澄清的石灰水变浑浊(或生成白色沉淀)。反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O
(4)一氧化碳有毒,可污染空气。不能将一氧化碳气体排放到空气中。所以应将尾气点燃惧或收集。
[定量分析]
固体X的成分为铁和铜;基中铁与稀盐酸反应。方程式为:Fe+2HCl=FeCl2+H2↑。所以气体A为氢气(H2)。有色溶液B中含有的溶质有反应生成的FeCl2(溶液为浅绿色)和过量未反应的HCl(稀盐酸)。由于稀盐酸过量,由原固体X中的铁完全反应。所以固体C为铜,其质量为4g。
(3)可先根据气体A(H2)为0.4g,计算出铁的质量,再计算出氧化铁的质量。
计算过程:
解:设铁的质量为x
Fe+2HCl=FeCl2+H2↑
56 2
x 0.4g
56:2=x:0.4g
x=11.2g
则氧化铁(Fe2O3)的质量为: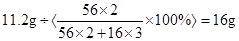
原混合物“氧化铁和铜粉”中铜的质量分数为: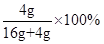 =20%
=20%
考点:炼铁的原理、物质的推断、根据化学式的计算、根据化学方程式的计算

某化学兴趣小组对一包干燥的红色粉末组成进行探究,该红色粉末可能由Cu 、Fe2O3两种固体中的一种或两种组成。
【提出猜想】红色粉末可能是:①Cu ②Fe2O3 ③Cu和Fe2O3
【查阅资料】(1)白色无水CuSO4遇水变蓝
(2)Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
【实验探究】
[甲组同学]:定性检测该红色粉末的物质组成
(1)小云取少量红色粉末于试管中,滴加足量稀盐酸,充分振荡后观察,发现固体全部溶解,得有色溶液。则猜想 一定不成立,其中一定发生反应的化学方程式为 。
(2)小伟向小云得到的有色溶液中插入一根洁净的铁丝,反应充分后,观察到
现象,得出猜想③成立。
[乙组同学]:定量测定该红色粉末中氧化铁的质量分数
实验步骤:小晨称取该红色粉末5.0g装入硬质玻璃管中,按下图进行实验。开始时缓缓通入CO气体,过一段时间后再高温加热使其充分反应。待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却。反应前后称量相关物质的总质量(装置内空气中的水蒸气、CO2忽略不计),其数据如下表:
| | 反应前 | 反应后 |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为48.3 g | 玻璃管和固体物质的总质量为47.1 g |
| Ⅱ 组 | 洗气瓶和瓶中所盛物质的总质量为258.6 g | 洗气瓶和瓶中所盛物质的总质量为261.9 g |
【交流讨论】
(1)在装置A中先通CO气体的目的是 。A装置中发生反应的化学方程式为 。
(2)根据上述表格中的实验数据计算:红色粉末中氧化铁的质量分数为 。
(3)从环保角度看上述装置有严重不足之处。你认为应该如何改进? 。
【拓展延伸】对实验后B装置洗气瓶内溶液做进一步探究
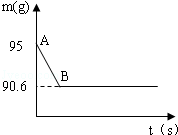
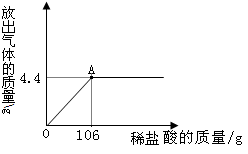
实验步骤:小渊同学取该洗气瓶内溶液54.4克(假设溶质只有碳酸钠一种),逐滴加入稀盐酸50克至无气泡冒出为止,生成二氧化碳4.4克。试计算:
(1)加入稀盐酸的溶质质量分数。
(2)反应后所得溶液的溶质质量分数。

 2H2O+O2↑)
2H2O+O2↑) Ti + 2MgCl2,若要制得96 g钛,计算至少需要镁的质量。
Ti + 2MgCl2,若要制得96 g钛,计算至少需要镁的质量。