��Ŀ����
����Ŀ��Ϊ��̽�����ʵĻ�ѧ���ʣ��о�С��������ͼ��ʾʵ�顣
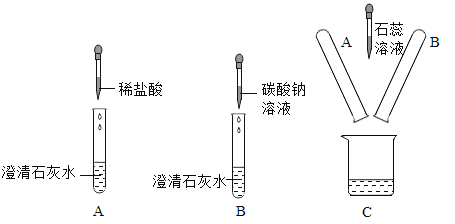
��1����ȡ A ������Һ����������ʯ����Һ����Һ�Ժ�ɫ���� A ������Һ��һ�����е�������_____��д��ѧʽ����
��2��B �Թ��е�ʵ������_____��B ���������Ļ�ѧ��Ӧʽ��_____��
��3����ȡ B ������Һ�����������̪��Һ����Һ�Ժ�ɫ���ɴ˿�֪��B ������Һ��һ�����е�������_____��д��ѧʽ����
��4����Ӧ������С��ͬѧ����Ӧ�� A��B �Թ��е��ϲ���Һ����ྻ���ձ��С����ձ��еμ���ɫʯ����Һ����Һ��죬Ȼ���ձ��ڵ����ʹ��ˡ�Ϊ��ȷ����Һ�����ʵijɷ֣�С��ͬѧ����������̽����
���������룩����һ��NaCl �������NaCl��HCl ��������NaCl��HCl ��CaCl2
�����۽���������Ϊ���ϲ���_____��������
��ʵ����֤��ͬѧ�ǶԿ��ܺ��е����ʽ���ȷ����С��ͬѧȡһ������Һ���Թ��У�����Һ ����μ���̼������Һ�������Ȳ�����������������ɳ�����
�����ۣ���������ó�������_____��ȷ ����������Ļ�ѧ����ʽ��_____��
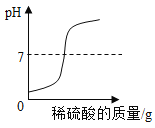
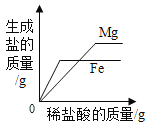
����չ��ߣ��������Ϸ�Ӧ����õ�������ʾ��ͼ��
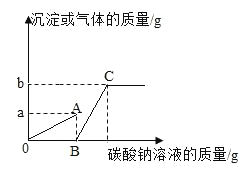
С��ͬѧ��ͼ������˷���������˵���������_____��
A O �� A ����������������
B O �� A �����У���Һ�� pH ���
C C ��ʱ��Ӧ����Һ��ֻ����������
D ��������ֻ�����˸��ֽⷴӦ
���𰸡�CaCl2��HCl �а�ɫ�������� Ca(OH)2+ Na2CO3=CaCO3��+2 NaOH NaOH һ �� Na2CO3+2HCl=2NaCl+H2O+CO2�� C
��������
��1������ʯ����Ϊ��ɫ��˵����Һ�����������A��Һ��һ�����е�������CaCl2��HCl��
��2��B������������̼���Ʒ�Ӧ����̼��Ƴ�����������Ϊ�а�ɫ�������ɡ�̼�������������Ʒ�Ӧ����̼��Ƴ������������ƣ���Ӧ�ķ���ʽΪ��Ca(OH)2+ Na2CO3=CaCO3��+2 NaOH
��3����̪�����Ա�죬ֻ��˵����Һ�Լ��ԣ�̼�������������Ʒ�Ӧ����̼��Ƴ������������ƣ�����Һһ����Ϊ��ɫ������Һ��һ�����е��Ƿ�Ӧ���ɵ��������ƣ����ܺ��й������������ƻ������̼���ơ����NaOH��
��4��[���۽���] ���ձ��еμ���ɫʯ����Һ����Һ��죬˵����Һ��һ������ϡ���ᣬ�ʲ���1��������
[����] ����Һ����μ���̼������Һ�������Ȳ�����������������ɳ�����˵����Һ��һ������ϡ������Ȼ��ƣ�̼������ϡ����������ų���̼�������Ȼ��Ʒ�Ӧ�а�ɫ�������ɣ��ʲ�������ȷ��̼������ϡ���ᷴӦ�����Ȼ��ƺͶ�����̼��ˮ����Ӧ�ķ���ʽΪ��Na2CO3+2HCl=2NaCl+H2O+CO2����
[��չ���]����Һ�м���̼���ƣ�̼�����Ⱥ�ϡ���ᷴӦ���ɶ�����̼���壬��ϡ���ᷴӦ��ȫ��̼���ƺ��Ȼ��Ʒ�Ӧ����̼��Ƴ�������A��ȷ��OA��ϡ�������٣���Һ��pH�����ӣ���B��ȷ��A�����Һ�е��������Ȼ��ƺ��Ȼ��ƣ�C��ʱ�Ȼ�����̼������ȫ��Ӧ����C��ʱ��Һ�е�����ֻ�����Ȼ��ƣ��ʴ���OA�κ�AC�ζ��������Ǹ��ֽⷴӦ������ȷ����ѡC��

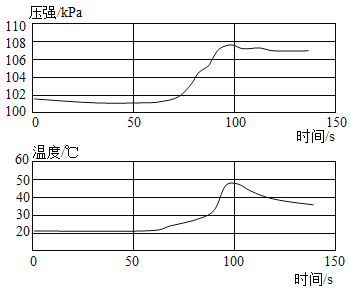
����Ŀ����������ͼ���е���Ϣ��ѧϰ��ѧ��һ����Ҫ�����������ܽ�ȱ����ܽ�����ش����⣺
�¶�/��c | 0 | 10 | 20 | 30 | 40 | 50 |
NH4C1�ܽ��/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
NaCl�ܽ��/g | 35.7 | 35.8 | 36.0 | 36,3 | 36. 6 | 37.0 |
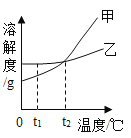
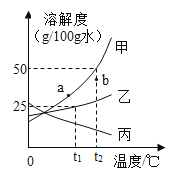
��1���Ȼ��Ƶ��ܽ��������_____����"����������������
��2��20��ʱ����40 gNH4Cl����100 g��ˮ�У���ֽ����õ�����______����������������������������Һ����������Һ���µ�30 ��C,����Һ��������������Ϊ__
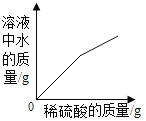
��3��t1 ��Cʱ�����ס����������ʵı�����Һ��100 g�ֱ��������5 gˮ,��������������_____������������'��������
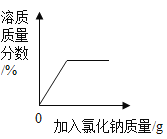
��4����������50 g��������Ϊ3%��NaCl��Һ������������Ϊ6%��NaCl��Һ���������Ҫ�õ���������_____������ĸ����
A 3%��NaCl��Һ���ܶ� B ˮ���ܶ� C 6%��NaCl��Һ���ܶ�