题目内容
【题目】甲、乙、丙三种物质的溶解度曲线如图所示(不含结晶水),请回答:
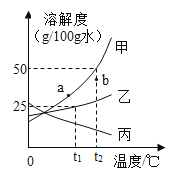
(1)0℃时,甲、乙、丙的溶解度最大的是_______。
(2)t2℃时,将30g甲固体加入到50g水中,充分搅拌后的所得溶液是_______(填“饱和”“不饱和”)。
(3)若甲中含有少量乙,应用__________法提纯甲。
(4)等质量的甲、乙、丙三种饱和溶液从t2℃降温至0℃后,溶液的质量分数由大到小的顺序是______________。
(5)若使甲溶液的状态从a点转化为b点,可采取的措施是__________
【答案】丙 饱和 降温结晶(或冷却热的饱和溶液) 乙>甲>丙 升温至t2,加溶质甲
【解析】
(1)通过分析溶解度曲线可知,0℃时,甲、乙、丙的溶解度最大的是丙;故填:丙;
(2)t2℃时,甲物质的溶解度是50g,所以将30克甲固体加入到50克水中,充分搅拌后只能溶解25g,所得溶液是饱和溶液;故填:饱和;
(3)甲物质的溶解度受温度变化影响较大,所以若甲中含有少量乙,应用降温结晶法或冷却热的饱和溶液提纯甲;故填:降温结晶(或冷却热的饱和溶液);
(4)0℃时,丙物质的溶解度最大,乙物质的溶解度次之,甲物质的溶解度最小,降低温度,甲、乙物质的溶解度减小,丙物质的溶解度增大,丙溶液质量分数应该按照t2℃时的溶解度计算,所以等质量的甲、乙、丙三种饱和溶液从t2℃降温至0℃后,溶液的质量分数由大到小的顺序是乙>甲>丙;故填:乙>甲>丙;
(5)a点是t1℃时甲的饱和溶液,b点在甲物质的溶解度曲线的下方,为t2℃时甲的不饱和溶液,且a点溶质的质量小于b点溶质的质量,若使甲溶液的状态从a点转化为b点,可采取的措施是:升温至t2,加溶质甲;故答案为:升温至t2,加溶质甲;故填:升温至t2,加溶质甲。

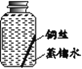
【题目】某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。
I.探究铜锈的组成
【查阅资料】① 铜锈受热易分解 ② 硫酸铜粉末遇水由白色变为蓝色
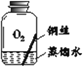
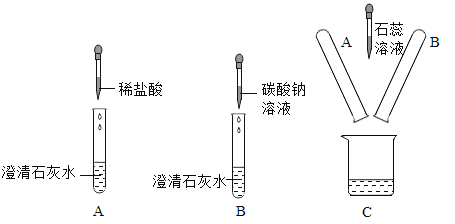
【进行实验】 小组同学从铜器上取下适量的干燥铜锈,按图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C中澄清石灰水变浑浊。
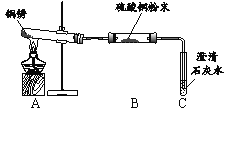
【解释与结论】(1)C中反应的化学方程式是______。
(2)依据以上现象分析,铜锈中一定含有的元素:Cu和______。
II.探究铜生锈的条件
【提出猜想】根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
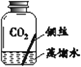
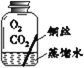
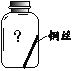
【进行实验】实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面 有绿色物质 | 无明显现象 | 无明显现象 |
【解释与结论】
(3)实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是______。
(4)得出“铜生锈一定与CO2有关”的结论,依据的两个实验是______(填编号)。
(5)对比实验②和③,得出的结论是______。
(6)为验证猜想,请在图中将实验⑤补充完整。______
(7)由上述实验可推知,铜生锈的条件是______。
【反思与应用】
(8)结合上述实验,你对保存铜制品的建议是______。