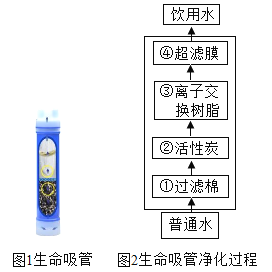
题目内容
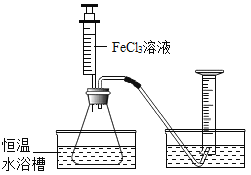
【题目】FeCl3溶液能对过氧化氢的分解起催化作用。某小组拟用下面所示装置其他条件相同时,过氧化氢溶液的浓度对过氧化氢分解速率的影响。实验方案:倒扣的量筒内装满水,分别取相同体积、相同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCL3溶液,有关数据如下表所示:
物理量 实验序号 | H2O2的溶液的浓度 | H2O2溶液的体积 | 2%FeCl3溶液的体积(mL) | 反应的时间(min) | 生成O2的体的体积(mL) |
1 | 5% | 20 | 3 | 1 | 待测V1 |
2 | 10% | 20 | 3 | X | 待测V2 |
有关该实验有如下说法,其中正确的是( )
A. 表中x未待测的物理量
B. 如果俯视读数,会导致的测量值偏大
C. 该实验方案通过比较产生相同体积氧气所需的时间来比较反应速率
D. 通过观察锥形瓶中冒气泡的速率和量筒内水下降速率,可以粗略判断反应速率
【答案】D
【解析】
A、本实验是探究过氧化氢溶液的浓度对过氧化氢分解速率的影响,具体操作是倒扣的量筒内装满水,分别取相同体积、相同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,利用的是控制变量法,变量是氧化氢溶液的浓度,表中x是表示时间,应该是已知量,故A错;
B、正确的读数方法是视线保持水平直视,与凹液面的最低处保持水平。如果俯视读数,会导致的测量值偏小,故B错;
C、该实验方案通过比较相同体积、不同浓度的过氧化氢溶液在相同时间内产生氧气的体积的多少来比较反应速率,故C错;
D、通过观察锥形瓶中冒气泡的速率和量筒内水下降速率,可以粗略判断反应速率,故D正确。
故选D。

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目