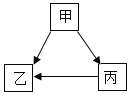
题目内容
【题目】碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(KIO3)。如图是超市销售的一种加碘盐标签的部分文字说明,请回答下列问题:

(1)该碘酸钾由_____种元素组成。它的相对分子质量为_____,碘酸钾中钾、碘、氧、三种元素比为_____。
(2)碘酸钾中碘元素的质量分数为_____(结果保留到0.1%)
(3)每袋该食盐中碘酸钾的质量为多少毫克?_____(结果保留到0.1mg)
【答案】3 214 39:127:48 59.3% 10.0
【解析】
(1)由碘酸钾化学式KIO3可知,氯酸钾由K、I、O三种元素组成;碘酸钾( KIO3 )的相对分子质量是39+127+16×3=214;碘酸钾中钾、碘、氧三种元素质量比为39:127:(16×3)=39:127:48;
(2)碘酸钾中碘元素的质量分数=![]() ×100%=59.3%;
×100%=59.3%;
(3)根据题意,食盐的含碘量为20mg/kg,每袋该食盐的质量为500g,则每袋该食盐中碘元素的质量为20mg×![]() =10.0mg。
=10.0mg。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
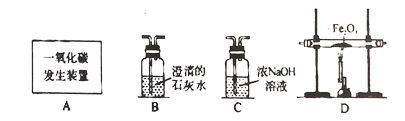
小学生10分钟应用题系列答案【题目】FeCl3溶液能对过氧化氢的分解起催化作用。某小组拟用下面所示装置其他条件相同时,过氧化氢溶液的浓度对过氧化氢分解速率的影响。实验方案:倒扣的量筒内装满水,分别取相同体积、相同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCL3溶液,有关数据如下表所示:
物理量 实验序号 | H2O2的溶液的浓度 | H2O2溶液的体积 | 2%FeCl3溶液的体积(mL) | 反应的时间(min) | 生成O2的体的体积(mL) |
1 | 5% | 20 | 3 | 1 | 待测V1 |
2 | 10% | 20 | 3 | X | 待测V2 |
有关该实验有如下说法,其中正确的是( )
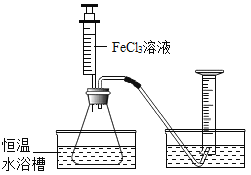
A. 表中x未待测的物理量
B. 如果俯视读数,会导致的测量值偏大
C. 该实验方案通过比较产生相同体积氧气所需的时间来比较反应速率
D. 通过观察锥形瓶中冒气泡的速率和量筒内水下降速率,可以粗略判断反应速率
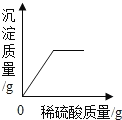
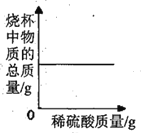
【题目】分析处理图表中的信息是学习化学的种重要方法。
(1)下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
①.30℃时,KNO3溶液的最大浓度(溶质质量分数)为________(只列计算式,不需要计算结果).
②.根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是_____。
(2)根据电解水的实验,回答下列问题:
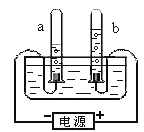
①.从宏观上观察:图示a、b管中产生的体积比约为2:1,则他们的质量比为_________。
②.从微观上分析:下列说法错误的是_________(填字母)。
A.水是由水分子构成的
B.水是由氢原子和氧原子构成的
C.每个水分子是由2个氢原子和1个氧原子构成的
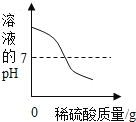
(3)如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答。
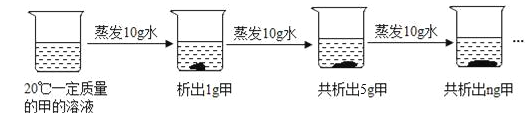
①蒸发前原溶液是_______(填“饱和”或“不饱和”)溶液,n的数值是______。
②依据上述实验,你认为甲的溶解度随温度变化的趋势是________(填序号)。
A.随温度升高而增大 B随温度升高面减小 C无法判断。