题目内容
【题目】在学习酸碱中和反应时,某班化学活动小组的同学们设计并进行了如下实验探究:
【提出问题】氢氧化钠溶液和稀硫酸是否能发生反应,若二者可以发生反应贝Ⅱ何时恰好反应。
【设计与实验】
甲组:取一定量的氢氧化钠溶液于试管中,然后向其中加几滴石蕊溶液,再向其中倾倒稀硫酸,并用玻璃棒搅拌,观察现象。
乙组:取一定量的氢氧化钠溶液于试管中,然后向其中加几滴酚酞溶液,再向其中逐滴滴加稀硫酸,并且边滴加边振荡,观察现象。
【讨论与交流】有些同学认为:甲组实验在操作上存在问题,你认为存在的问题是_____________。
有些同学认为甲组同学的实验不仅仅操作存在问题,在试剂的选择上也有不足,用“石蕊"溶液可以达到判断二者是否能发生反应的目的,但无法准确判断二者何时恰好反应,你认为他们的理由是____________;
【得出结论】通过上述分析,同学们认为还是乙组的实验同时达到了上述两个目的。
【表达与交流】请你根据所学知识判断乙组整个实验过程的现象是____________________。
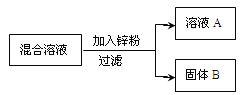
【设计与实验】通过上述讨论交流同学们感觉意犹未尽,于是老师给了相关资料(即:酸和盐、碱和盐的反应关系及条件)并提出要求:“要用盐溶液,对上述结论加以证明”,按照老师的要求甲组同学又重新设计并进行了一个实验,过程如下图。

【现象与结论】同学们在B中观察到有蓝色沉淀生成,则B中一定发生的化学反应方程式为______________;
【讨论与交流】同学们和老师探讨以后认为,该实验可以达到实验目的,但还需知道一系列相关的数据。实验要求过高,比较复杂!
【结论与总结】结合上述三个探究过程的比对以及师生之间的交流分析,你认为在判断两种物质能否反应并且要清楚是否恰好完全反应,在设计和进行实验时,应注意和考虑___________________因素,才既可以达到实验目的又是比较理想的方法。
【答案】
【讨论与交流】倾倒稀硫酸和用玻璃棒搅拌 ;若溶液由蓝色变成红色,说明溶液中不存在碱,即发生了反应;蓝色到紫色现象不明显,无法准确观察恰好反应的实验现象;
【表达与交流】溶液由无色变成红色,溶液又由红色变成无色;
【现象与结论】2NaOH+CuSO4==Cu(OH)2↓+Na2SO4
【结论与总结】操作正确且准确、所选试剂要适当和适量、步骤尽量简单。
【解析】
试题分析:【讨论与交流】氢氧化钠溶液和稀硫酸是否能发生反应,可通过指示剂元素的变化来进行判断。故取一定量的氢氧化钠溶液于试管中,然后向其中加几滴石蕊溶液,再向其中滴加稀硫酸,并振荡。若是采用倾倒稀硫酸的方法可能会导致加入的稀硫酸过量;紫色石蕊遇碱变成蓝色,但由于紫色和蓝色不明显,故不能准确观察到前后完全反应的现象;故一般不用紫色石蕊,而是用无色酚酞;
【表达与交流】取一定量的氢氧化钠溶液于试管中,然后向其中加几滴酚酞溶液,无色酚酞会变成红色;再向其中逐滴滴加稀硫酸,稀硫酸与氢氧化钠溶液反应,当前后完全反应时溶液呈中性,红色又会变成无色;
【现象与结论】硫酸铜只能和氢氧化钠反应生成氢氧化铜这种蓝色沉淀:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4;
【结论与总结】判断两种物质能否反应并且要清楚是否恰好完全反应,在设计和进行实验时,应注意和考虑操作正确且准确、所选试剂要适当和适量、步骤尽量简单。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案