题目内容
【题目】波尔多液是一种运用广泛的农药,由熟石灰和硫酸铜配制而成。某工厂用以下反应:![]() 来生产硫酸铜。试回答下列问题:
来生产硫酸铜。试回答下列问题:
(1)波尔多液中发生的反应为_______________
(2)硫酸铜中阴离子符号为________________
(3)硫酸铜中____________(填符号)元素的质量分数最小。
(4)若要制得80kg硫酸铜,需要硫酸的质量为多少__________
【答案】CuSO4+Ca(OH)2=CaSO4+Cu(OH)2↓ ![]() S 49kg
S 49kg
【解析】
(1) 波尔多液中硫酸铜和氢氧化钙反应生成氢氧化铜沉淀和硫酸钙,反应的化学方程式为:CuSO4+Ca(OH)2=CaSO4+Cu(OH)2↓;故填:CuSO4+Ca(OH)2=CaSO4+Cu(OH)2↓;
(2)硫酸铜有铜离子和硫酸根离子构成,硫酸铜中阴离子为硫酸根离子,符号为![]() ;故填:
;故填:![]() ;
;
(3)硫酸铜中铜、硫、氧元素的质量比为64:32:(16×4)=2:1:2,则硫元素的质量分数最小。故填:S;
(4)设要制得80kg硫酸铜,需要硫酸的质量为x
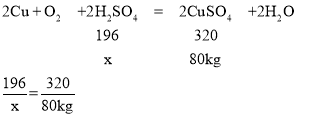
x=49kg
故填:49kg。

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目