题目内容
【题目】水和溶液在生产、生活中起着十分重要的作用。
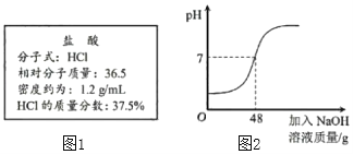
(1)近日,浙江大学研制出世界上最轻的材料“碳海绵”,它被预测可代替活性炭用于净水,说明它有较强的_____性。
(2)如图1实验中,当试管1中气体的体积为6mL时,试管2中气体体积约为_____mL。
(3)欲使图2中乙溶液的状态从P点转化为C点,可采取的措施是_____。
(4)图2,t2℃时,把56g乙物质加入到200水中充分搅拌、静置,形成的是_____溶液(填“饱和”或“不饱和”)。
(5)图2中,将150g甲的饱和溶液从t3℃降到t2℃后,向其中加入50g水,此时所得溶液的溶质质量分数是_____(计算结果精确到0.1%)。
【答案】吸附 3 增加溶剂 不饱和 21.9%
【解析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
(1)活性炭具有疏松多孔的结构,具有吸附性,所以“碳海绵”被预测可代替活性炭用于净水,说明它有较强的吸附性。
(2)如图1实验中,水在通电的条件下生成氢气和氧气,正氧负氢,体积比是2:1,当试管1中气体的体积为6mL时,试管2中气体体积约为3mL。
(3)欲使图2中乙溶液的状态从P点转化为C点,可采取的措施是增加溶剂。
(4)t2℃时,乙物质的溶解度是30g,所以把56g乙物质加入到200水中充分搅拌、静置,形成的是不饱和溶液。
(5)t3℃时,甲物质的溶解度是50g,150g甲的饱和溶液中含水的质量为:![]() ,含溶质的质量为150g100g=50g,将150g甲的饱和溶液从t3℃降到t2℃后,甲的溶解度减小至28g,析出的晶体的质量为50g28g=22g,向其中加入50g水,此时所得溶液中水的质量为100g+50g=150g,150g水中最多能溶解甲的质量为
,含溶质的质量为150g100g=50g,将150g甲的饱和溶液从t3℃降到t2℃后,甲的溶解度减小至28g,析出的晶体的质量为50g28g=22g,向其中加入50g水,此时所得溶液中水的质量为100g+50g=150g,150g水中最多能溶解甲的质量为
![]() ,又继续溶解甲的质量为42g28g=14g,剩余晶体的质量为22g14g=8g,因此此时所得溶液为甲在t2℃时的饱和溶液,此时所得溶液的溶质质量分数是
,又继续溶解甲的质量为42g28g=14g,剩余晶体的质量为22g14g=8g,因此此时所得溶液为甲在t2℃时的饱和溶液,此时所得溶液的溶质质量分数是![]()

【题目】某样品为铜和氧化铜的混合物,为测定样品中氧化铜的含量,甲、乙、丙、丁四位同学用同一样品分别进行实验,测定的实验数据如下表。请分析数据解答下列问题:
甲 | 乙 | 丙 | 丁 | |
所取固体样品的质量 | 25 | 25 | 20 | 20 |
加入硫酸溶液质量 | 50 | 100 | 100 | 120 |
反应剩余固体质量 | 21 | 17 | 12 | 12 |
(1)四位同学中, 同学所取的硫酸溶液质量不足(从“甲”、“乙”、“丙” 或“丁”中选择填写);
(2)混合物氧化铜的质量分数为?
(3)硫酸溶液中溶质的质量分数为?
【题目】实验室现有硫酸镁和硫酸钠的固体混合物样品,诺贝尔同学想测定样品中硫酸镁的质量分数,先称取该混合物样品20g,完全溶于100g水中。然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
次数 | 1 | 2 | 3 | 4 |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 2.9 | x | 8.7 | 8.7 |
(1)上表中x的数值为_____。
(2)求原固体混合物样品中硫酸镁的质量分数。(写出计算过程)
(3)恰好完全反应时,溶液中溶质的质量分数为_____(结果精确到0.1%);若用氢氧化钡溶液代替氢氧化钠溶液来测定样品中硫酸镁的质量分数,是否可行?并说明理由:_____。
【题目】下列除杂(括号内为杂质)的试剂选用正确的是( )
序号 | 物质 | 选用试剂 |
A | CaCl2溶液(盐酸) | 过量的Na2CO3溶液 |
B | NaOH溶液(Na2CO3溶液) | 适量的Ca(OH)2溶液 |
C | CuO(Cu) | 足量的稀H2SO4 |
D | KCl溶液(K2SO4溶液) | 适量的BaCl2溶液 |
A.AB.BC.CD.D
【题目】活性炭内部有许多微细孔隙,可用于脱色,脱色原理的微观示意图如图。实验小组对活性炭使有色物质褪色进行探究。
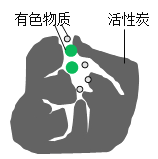
(猜想假设)有色物质的微粒被吸附在活性炭孔隙里,从而褪色。
(查阅资料)
i.品红溶液、水果口味汽水、红墨水等溶液中均含有有颜色的有机物。有机物是指含碳元素的化合物,但不包括碳的氧化物、碳酸和碳酸盐。
ii.高锰酸钾(KMnO4)为无机物,其水溶液为紫红色。MnSO4可以与铋酸钾反应生成KMnO4。
(进行实验)
将下列5种溶液,各取20 mL,依次倒入5个相同的自制活性炭净水器中,如图,放置相同时间,打开活塞,观察溶液颜色,现象见下表。
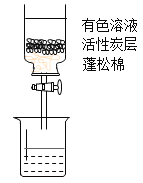
实验编号 | ① | ② | ③ | ④ | ⑤ |
有色溶液 | 品红溶液 | 橙味汽水 | 红墨水 | 酸性KMnO4溶液 | CuSO4溶液 |
现象 | 红色溶液褪为无色 | 橙黄色溶液褪为无色 | 红色溶液褪为无色 | 紫红色溶液 褪为无色 | 蓝色溶液 无明显变化 |
(结果讨论)
(1)在上述实验①~⑤中,活性炭更容易使有颜色的______(填“无机物”或“有机物”)褪色。
(2)若用紫色葡萄味汽水做上述实验,可以观察到的现象是______。
(3)已知品红溶液中有色物质微粒直径d约为1.0 nm,结合猜想推测品红溶液褪色的原因:活性炭孔隙直径D_____(填“≥”或“≤”)d,有色物质的微粒被吸附在活性炭孔隙里,从而褪色。
(深入探究)小组同学对酸性KMnO4溶液的褪色产生兴趣并继续探究。
(4)KMnO4是自身见光分解了吗?有同学发现高锰酸钾溶液盛放在棕色试剂瓶中,而棕色试剂瓶用于盛放见光易分解的化学药品,由此猜测高锰酸钾溶液可能在进行实验④时由于见光分解而褪色。小康同学设计了合理的对照实验证明这个猜测不成立。
实验方案:取20 mL相同浓度的酸性KMnO4溶液,______,放置相同时间,溶液颜色无明显变化。
(5)KMnO4是与活性炭发生反应了吗?
老师查阅文献:活性炭能与酸性KMnO4溶液发生反应,生成几乎无色的MnSO4,从而使溶液褪色。小组同学设计实验:取实验④出水口的溶液于试管中,向其中加入试剂X。预设观察无色溶液是否变为紫红色。则试剂X是______。
(实验反思)
(6)活性炭使有色物质褪色时发生的变化可能有______(填“物理”或“化学”或“物理和化学”)变化。
【题目】碳酸钠是重要的化工原料。吕布兰、索尔维和侯德榜为它的工业化生产作出了巨大贡献。
Ⅰ、吕布兰法:1789年,法国医生吕布兰(N. Leblanc, 1742 -1806)以食盐、浓硫酸、木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如图:
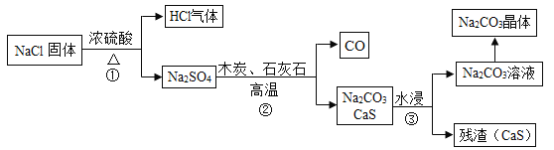
(1)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为____;
(2)③中”水浸”时通常需要搅拌,其目的是____;
(3)吕布兰法有明显不足,不断有科学家进行改进,请写出该法不足之处__(一处即可)。
II、索尔维法: 1892 年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。原理如下:
![]()
![]()
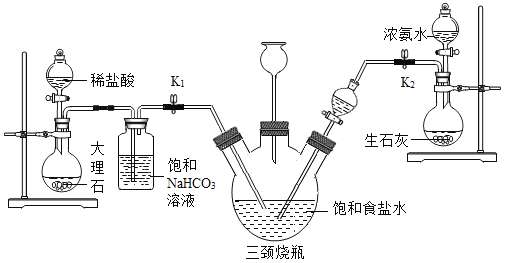
某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。实验操作如下:
①关闭K1,打开K2,通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭 K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
请回答下列问题:
(4)三颈烧瓶上连接的长颈漏斗的主要作用是_______,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是______;关闭K2停止通NH3后,还要继续通CO2一段时间,其目的是_______;
(5)根据实验记录,计算t2时NaHCO3固体的分解率为______( 已分解的NaHCO3质量与加热前原NaHCO3质量的比值)。