题目内容
【题目】实验室现有硫酸镁和硫酸钠的固体混合物样品,诺贝尔同学想测定样品中硫酸镁的质量分数,先称取该混合物样品20g,完全溶于100g水中。然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
次数 | 1 | 2 | 3 | 4 |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 2.9 | x | 8.7 | 8.7 |
(1)上表中x的数值为_____。
(2)求原固体混合物样品中硫酸镁的质量分数。(写出计算过程)
(3)恰好完全反应时,溶液中溶质的质量分数为_____(结果精确到0.1%);若用氢氧化钡溶液代替氢氧化钠溶液来测定样品中硫酸镁的质量分数,是否可行?并说明理由:_____。
【答案】(1)5.8;(2)90%;(3)12.5%;不可行,氢氧化钡也会与杂质硫酸钠反应,影响测定结果
【解析】
(1)根据表中的第1~3次数据可知,第1次加入氢氧化钠溶液25 g生成沉淀2.9 g,第3次加入氢氧化钠溶液75 g生成沉淀8.7 g,则第2次加入氢氧化钠溶液50 g生成沉淀5.8 g。
(2)解:设混合物样品中硫酸镁的质量分数为x。
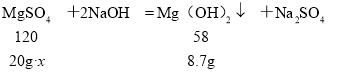
![]() , 解得:x=90%
, 解得:x=90%
(3)第3次加入75 g氢氧化钠溶液时,硫酸镁与氢氧化钠溶液恰好完全反应,设生成硫酸钠的质量为y。
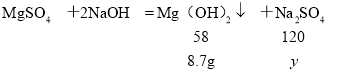
![]() ,解得:y=21.3 g
,解得:y=21.3 g
样品混合物中MgSO4的质量为20 g×90%=18 g
样品混合物中Na2SO4的质量为20 g-18 g=2 g
恰好安全反应时,溶液中Na2SO4的质量=21.3 g+2 g=23.3 g
恰好安全反应时,溶液中Na2SO4的质量分数=![]() ×100%≈12.5%。
×100%≈12.5%。
若用氢氧化钡溶液代替氢氧化钠溶液来测定样品中硫酸镁的质量分数,不可行,因为氢氧化钡也会与杂质硫酸钠反应产生硫酸钡沉淀,影响测定结果。