题目内容
【题目】同学们在实验室发现了一瓶没有塞子的氢氧化钠固体,为了探究瓶中固体的成分,同学们展开了探究。
(1)小明同学取了14.6g样品,加入足量的水充分溶解,再滴入足量的氯化钡溶液,过滤得到白色沉淀19.7g,求所取样品中氢氧化钠的质量,请写出计算过程。
(2)求14.6g样品中所含钠元素的质量为 ;
(3)小李同学也取14.6g样品,逐渐滴入7.3%的稀盐酸200g,观察到的现象为 ;若碳酸钠与稀盐酸的反应分为两步进行:第一步:Na2CO3+HCl= NaHCO3+ NaCl 第二步:NaHCO3+ HCl= NaCl+H2O+CO2↑下图横轴为稀盐酸的质量,纵轴为生成气体的质量,请画图。
【答案】4g;6.9g;一段时间后才开始产生气泡;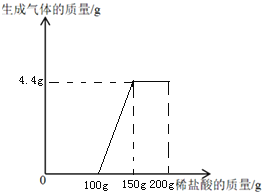
【解析】
(1)设样品中的碳酸钠的质量为x,
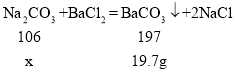
![]()
x=10.6g,
则样品中氢氧化钠的质量=14.6g-10.6g=4g;
(2)样品中钠元素的质量=4g×![]() ×100%+10.6g×
×100%+10.6g×![]() ×100%=6.9g;
×100%=6.9g;
(3)取14.6g样品,逐渐滴入7.3%的稀盐酸200g,氢氧化钠先与盐酸反应生成氯化钠和水,没有气泡产生;当氢氧化钠完全反应后,碳酸钠先与盐酸反应生成碳酸氢钠和氯化钠,而后碳酸氢钠再与盐酸反应氯化钠、水和二氧化碳,有气泡产生;
设与4g氢氧化钠反应需要7.3%的稀盐酸的质量为y,则:

![]()
y=50g;
设在反应Na2CO3+HCl=NaHCO3+NaCl中,10.6g碳酸钠消耗7.3%的稀盐酸的质量为z,生成碳酸氢钠的质量为m,则:
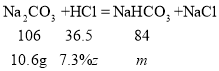
![]() z=50g,
z=50g,
![]() m=8.4g,
m=8.4g,
也就是开始滴加稀盐酸时没有气泡产生,当滴加到(50g+50g)=100g稀盐酸时才开始产生气泡;设8.4g碳酸氢钠消耗7.3%的稀盐酸的质量为n,生成二氧化碳的质量为w,则:

![]() n=50g,
n=50g,
![]() w=4.4g,
w=4.4g,
则图象为: 。
。

【题目】为了测定实验中氯酸钾样品的纯度,某兴趣小组取2.5克样品与0.8克二氧化锰混合。加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以下操作,依次称得加热t1、t2、 t3、t4时间后剩余固体的质量,记录数据如表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 2.48 | 2.41 | 2.34 | 2.34 |
请仔细分析实验数据,回答下列问题:
(1)在多长时间后,该样品中的氯酸钾已经反应完全。
(2)计算完全反应后生成氧气的质量为多少。
(3)求该样品中氯酸钾的质量分数。
【题目】在密闭容器中,乙醇充分燃烧,其反应前后各物质的质量变化如下表所示,分析不正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量(g) | 23 | 0 | 48 | m |
反应后的质量(g) | 0 | 27 | 0 | 45 |
A.甲代表的是反应物乙醇B.m=1
C.该反应不属于四种基本反应类型D.乙与丁的化学计量数之比为2:3