题目内容
【题目】在密闭容器中,乙醇充分燃烧,其反应前后各物质的质量变化如下表所示,分析不正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量(g) | 23 | 0 | 48 | m |
反应后的质量(g) | 0 | 27 | 0 | 45 |
A.甲代表的是反应物乙醇B.m=1
C.该反应不属于四种基本反应类型D.乙与丁的化学计量数之比为2:3
【答案】D
【解析】
由表中数据分析可知,反应前后的甲的质量减少了23g-0g=23g,故是反应物,参加反应的质量为23g;同理可以确定乙是生成物,生成的质量为27g-0g=27g;丙是生成物,生成的质量为48g-0g=48g;由质量守恒定律,丁应是生成物,且生成的质量为23g+48g-27g=44g,故m的质量为45g-44g=1g。
A、乙醇燃烧生成二氧化碳和水,反应的化学方程式为:C2H5OH+3O2![]() 2CO2+3H2O,各物质的质量比为23:48:44:27,参加反应的乙醇和氧气的质量比为46:96=23:48,则甲代表的是反应物乙醇,故选项说法正确;
2CO2+3H2O,各物质的质量比为23:48:44:27,参加反应的乙醇和氧气的质量比为46:96=23:48,则甲代表的是反应物乙醇,故选项说法正确;
B、m的质量为45g-44g=1g,则m=1,故选项说法正确;
C、乙醇在氧气中充分燃烧生成二氧化碳和水,该反应不属于四种基本反应类型,故选项说法正确;
D、由化学方程式可知,乙与丁的化学计量数之比3:2,故选项说法错误。
故选D。

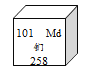
【题目】“双吸剂”是一种常见的袋装食品保鲜剂,它可以吸收氧气、水等物质,化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示。同学们对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究。

(提出问题)久置“双吸剂”固体的成分是什么?“双吸剂”失效了吗?
(作出猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3
(实验探究)下表是小明设计的实验方案和记录的实验报告,请你补充完整。
实验操作 | 实验现象 | 实验结论 |
取固体药品,观察颜色 | (1)_____________ | 固体中一定有Fe2O3 |
取少量固体药品,用磁铁吸引 | 部分固体被吸引 | 固体中一定有Fe |
取少量固体药品,加入足量蒸馏水,搅拌 | 固体部分溶解,放出热量 | (2)固体中一定有__________ |
过滤,取滤液滴加无色酚酞溶液 | 溶液变红 | 固体中一定含有Ca(OH)2 |
(3)取滤渣,加足量_________ | 固体逐渐消失,产生使澄清石灰水变浑浊的气体 | 固体中一定含有CaCO3 |
(实验反思)小组同学通过讨论认为上述实验结论有缺陷,应该是不一定有_____存在。
(拓展应用)取少量固体药品,加入足量蒸馏水,搅拌。发生反应的化学方程式为_____________。
(实验结论)“双吸剂”____________(填“失效”或“未失效”)