题目内容
【题目】现有如图装置、仪器和药品。根据要求回答问题:
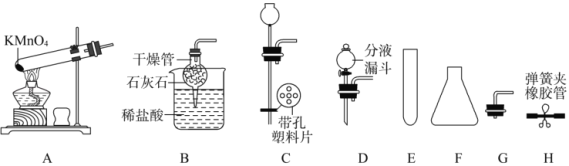
(1)写出仪器的名称:E_____、F_____。
(2)改正图A的实验室制氧气装置中的一处错误:_____。用装置A制取氧气,并用排水法收集,当___才能把导管伸入盛满水的倒放的集气瓶中,集满气体后,气瓶取离水面_____(填“前”或“后”)瓶口盖好玻片。
(3)B与H组合用以制取CO2,涉及反应方程式为_____。通过操作H中弹簧夹可以控制该反应的发生或停止;在“C至H”中选择仪器_____(填字母序号)也可组装一个随时使反应发生或停止的装置。若用H2O2溶液和MnO2制取O2,且能获得平稳的气流,应选E(或F)和_____组合。
(4)若要图I中的两个气球悬浮在空气中,则气体甲可能是_____(填数字序号)。
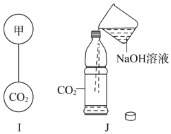
①SO2 ②O2 ③H2 ④CH4
(5)向图J中的塑料软瓶中倒入一定量的NaOH溶液,迅速拧紧瓶盖,振荡,可观察到瓶子变瘪。请解释这种现象的产生(用化学方程式作答):_____。
【答案】试管 锥形瓶 试管口向下倾斜(或试管口需要放棉花) 导管口出现连续均匀气泡时 前 CaCO3+2HCl═CaCl2+H2O+CO2↑ CEH D ③④ CO2+2NaOH=Na2CO3+H2O
【解析】
(1)由图可知,仪器E为试管,故填试管;
仪器F为锥形瓶,故填锥形瓶。
(2)加热高锰酸钾固体时,为避免有冷凝水回流至试管底部引起试管骤冷发生炸裂,所以加热时需要试管口向下倾斜,高锰酸钾为固体粉末,容易被气体带出试管,因此需要在试管口处方一团棉花进行过滤,故填试管口向下倾斜(或试管口需要放棉花);
选择排水法收集气体时,当导管口出现连续、均匀气泡时,便可以收集气体,故填导管口出现连续均匀气泡时;
由于空气与氧气可以相互扩散溶解,因此用排水法制备好的氧气在水下就盖好玻璃片,然后在取出,避免收集氧气不纯,故填前。
(3)实验室制取二氧化碳的反应是盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,故反应的化学方程式写为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
选择C作为固液反应发生容器的密封塞,且带有带孔塑料板,其上放固体,然后利用E作为固液发生容器,H作为控制气体输出的开关装置,控制压强,从而控制反应的发生与停止,故填CEH;
控制反应速率需要控制加入液体的量,因此选择带有分液漏斗的D和E(或F)组成发生装置,故填D。
(4)根据气球位置可知甲的密度比空气小,所以甲中气体为氢气和甲烷,二氧化硫和氧气密度比空气大,因此不能选择,故填③④。
(5)二氧化碳与氢氧化钠反应生成碳酸钠和水,故反应的化学方程式写为:CO2+2NaOH=Na2CO3+H2O。

【题目】宜城葛洲坝水泥厂生产的水泥畅销各地,生产的原料之一是石灰石。某化学兴趣小组对石灰石纯度进行探究。取该石灰石样品16g,把200g稀盐酸分四次加入,测量探究过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水也不与稀盐酸反应)。请计算:
序号 | 加入稀盐酸的质量/g | 剩余固体质量/g |
第1次 | 50 | 11 |
第2次 | 50 | 6 |
第3次 | 50 | 3.2 |
第4次 | 50 | m |
(1)表中m的数值为 ;石灰石纯度是 。
(2)求第2次反应完毕后所得溶液溶质的质量分数(写出解题过程,结果精确到0.1﹪)
【题目】材料是人类赖以生存和发展的重要物质,目前使用量最多的金属材料仍然是钢铁。
(一)单质铁钉的一系列变化。
![]()
(1)变化①的原因是铁与空气中的水、______等物质发生一系列复杂反应的结果。
(2)变化②的实验现象是:铁锈消失,______,发生反应的化学方程式为______
(二)铁及其化合物的实验
硫酸亚铁铵(俗称摩尔盐)化学式为FeSO4· (NH4)2SO4· 6H2O,是一种重要的化工原料, 用途十分广泛。
Ⅰ 硫酸亚铁铵晶体制备。 资料:溶质从溶液里结晶析出时,晶体里结合着一定数目的水分子,这样的水分子叫结晶水。 硫酸亚铁铵晶体易溶于水,不溶于乙醇。
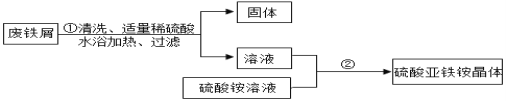
(1)在步骤①前要对废铁屑进行预处理,先利用洗涤剂的______作用除去油污。
(2)操作②中发生了一系列变化,目的是得到硫酸亚铁铵晶体。其中的操作顺序是: b→______→______→d;
a 过滤b 加热浓缩c 降温结晶d 洗涤干燥
(3)操作②中使用乙醇洗涤。这样做的优点是______;
A 避免用水洗涤所造成的晶体损耗B 酒精易挥发,可低温晾干晶体
Ⅱ 硫酸亚铁铵晶体热分解实验
兴趣小组称取此晶体样品 39.2g,在科研人员的指导下用如图装置进行热分解实验。
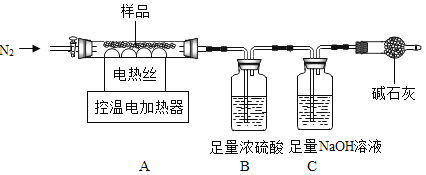
(查阅资料)①硫酸亚铁铵晶体在 200℃完全失去结晶水,剩余物在 500℃完全分解为铁的某氧化物、SO2、SO3、NH3 和 H2O。
②B 装置中浓硫酸只能吸收 NH3、SO3 和 H2O。
(1)装配好实验装置后,先要______。
(2)控制不同的温度对 A 中固体加热,测得装置 B 和 C 中的质量变化如表。
A装置中温度/℃ | 室温 | 100 | 500 |
B装置/g | 200.00 | X | 228.00 |
C装置/g | 100.00 | 100.00 | 103.20 |
①表格中 X=______。
②请你根据表中实验数据,计算出最终生成的 SO3 质量______?(写出计算过程)
(3)加热前后及过程中均需通入 N2,停止加热后继续通 N2 的目的是防止液体倒吸和______