题目内容
如图是某浓盐酸试剂瓶上标签的部分内容。通过计算回答下列问题:
(1)该浓盐酸的质量是多少克?
(2)将该瓶浓盐酸全部配制成溶质质量分数为11.8%(密度约为1.06g/ml)的盐酸,需加入水多少ml(ρ水=1g/ml);
(3)将石灰石100g与足量稀盐酸充分反应(假设杂质不与稀盐酸反应),得到CO2 0.6 mol。
① 0.6 mol CO2其质量是 克。
② 该石灰石含碳酸钙的质量分数是多少?
| 盐酸(分析纯) 化学式:HCl 质量分数:36% 密度:1.18g/ml 体积:500ml |
(2)将该瓶浓盐酸全部配制成溶质质量分数为11.8%(密度约为1.06g/ml)的盐酸,需加入水多少ml(ρ水=1g/ml);
(3)将石灰石100g与足量稀盐酸充分反应(假设杂质不与稀盐酸反应),得到CO2 0.6 mol。
① 0.6 mol CO2其质量是 克。
② 该石灰石含碳酸钙的质量分数是多少?
(1)590 g (2)1210 ml (3)①26.4 g ②60%
试题分析:(1)该浓盐酸的质量是m(浓盐酸)=500×1.18=590 g;
(2)590×36%=m(稀盐酸)×11.8%
m(稀盐酸)="1800" g
m(水)=1800-590=1210 g
V(水)=
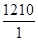 =1210 ml
=1210 ml (3)①0.6 mol CO2其质量是0.6×44="26.4" g
②设该石灰石含碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 26.4g
100:44=x:26.4g
x="60" g
CaCO3%=
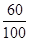 ×100%=60%
×100%=60% 答:(1)该浓盐酸的质量是590g;
(2)将该瓶浓盐酸全部配制成溶质质量分数为11.8%(密度约为1.06g/ml)的盐酸,需加入水1210ml;
(3)① 0.6 mol CO2其质量是26.4克。
② 该石灰石含碳酸钙的质量分数是60%。
点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。

练习册系列答案
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
 ”分别表示氢和氧两种元素的原子。(已知氢、氧两种原子的相对原子质量分别为:H-1 O-16)
”分别表示氢和氧两种元素的原子。(已知氢、氧两种原子的相对原子质量分别为:H-1 O-16)
 ,若用22克二氧化碳作为原料,则理论上能转化得到乙烯多少克?
,若用22克二氧化碳作为原料,则理论上能转化得到乙烯多少克?