题目内容
(3分)将一定质量的碳酸钠粉末溶于400g水中配制成溶液,取一半该溶液,向其中加入20%的盐酸至恰好完全反应,放出气体22g,试计算(均写出计算过程)
⑴碳酸钠溶液的总质量
⑵反应后所得溶液中溶质的质量分数
⑴碳酸钠溶液的总质量
⑵反应后所得溶液中溶质的质量分数
⑴506g, ⑵14.1%
试题分析:根据碳酸钠与盐酸的反应生成氯化钠、水和二氧化碳的化学方程式,由22g二氧化碳的质量,可计算出碳酸钠的质量,但要注意,取的是一半该溶液,即由生成的22g二氧化碳所计算得到的碳酸钠仅为原粉末质量的一半。
由于是恰好完全反应,所以,反应后所得溶液为氯化钠溶液,计算出反应生成氯化钠的质量与溶液质量比即可。
解:设需Na2CO3质量为x,HCl质量为y,生成NaCl质量为z
Na2CO3 + 2HCl ="=2NaCl" + H2O + CO2↑
106 73 117 44
x y z 22g
106:44 = x:22g
73:44 = y:22g
117:44 =" z" :22g
解得,x=53g,y=36.5g,z=58.5g
则⑴ Na2CO3溶液的总质量为:53g×2+400g=506g
⑵ 反应后所得溶液中溶质的质量分数为:
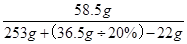 ×100%=14.1%
×100%=14.1% 答:⑴碳酸钠溶液的总质量是506g,⑵反应后所得溶液中溶质的质量分数为14.1%
点评:本题以化学方程式计算为基础,同时融入溶液等方面的计算题,这样的题目一直是中考的热点,主要培养学生的综合分析能力和计算能力;其中容易出错的地方是与盐酸反应的碳酸钠质量是碳酸钠粉末的一半,往往忽略这一点。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Ti + 2MgCl2,若要制得12 g钛,需要镁的质量是多少克?
Ti + 2MgCl2,若要制得12 g钛,需要镁的质量是多少克?

 2HCl)
2HCl)