题目内容
(10分)某石灰厂需要测定石灰石样品中CaC03的质量分数.小刚设计了下图所示装置来完成实验(杂质不与酸反应):
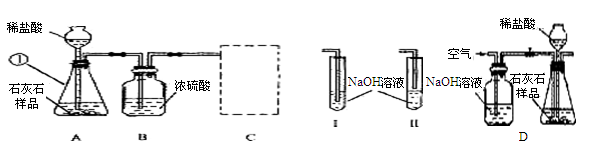
(1)写出下列仪器的名称①_______.
(2)c装置应当选择I、Ⅱ中的_______ (填“I”或“Ⅱ”),其作用是______________.
(3)小华提出,要使测定结果更准确,应把A装置改成右图所示装置,并在反应前、后通入空气,其目的是_____________________.
(4)取用4g石灰石样品,把20g稀盐酸分四次加入石灰石样品中(样品中除碳酸钙外,其余物质既不与酸反应,也不溶于水),充分反应后经过过滤、干燥等操作,最后称量,最终实验数据如下表:
求①该石灰石样品中碳酸钙的质量分数;
②该盐酸中溶质的质量分数.

(1)写出下列仪器的名称①_______.
(2)c装置应当选择I、Ⅱ中的_______ (填“I”或“Ⅱ”),其作用是______________.
(3)小华提出,要使测定结果更准确,应把A装置改成右图所示装置,并在反应前、后通入空气,其目的是_____________________.
(4)取用4g石灰石样品,把20g稀盐酸分四次加入石灰石样品中(样品中除碳酸钙外,其余物质既不与酸反应,也不溶于水),充分反应后经过过滤、干燥等操作,最后称量,最终实验数据如下表:
| 稀盐酸的用量 | 第一次加入5g | 第二次加入5g | 第三次加入5g | 第四次加入5g |
| 剩余固体的质量 | 3 | 2 | 1 | 1 |
②该盐酸中溶质的质量分数.
(1)锥形瓶 (2)I 充分吸收生成的CO2
(3)排除空气中CO2的干扰;使生成的CO2能被充分吸收
(4)①:75℅ ②:14.6℅
(3)排除空气中CO2的干扰;使生成的CO2能被充分吸收
(4)①:75℅ ②:14.6℅
试题分析:(1)仪器的名称①锥形瓶.
(2)c装置应当选择I、Ⅱ中的I,其作用是充分吸收生成的CO2.
(3)小华提出,要使测定结果更准确,应把A装置改成右图所示装置,并在反应前、后通入空气,其目的是排除空气中CO2的干扰,使生成的CO2能被充分吸收.
(4)由题中数据可知:每次加入5g稀盐酸,将反应掉1g碳酸钙,但第四次加入盐酸后,剩余固体仍为1g,即杂质是1g。故:
①该石灰石样品中碳酸钙的质量分数为
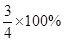 =75%;
=75%;②设该盐酸中溶质的质量分数为x%.
CaC03+2HCl=++CaCl2+H2O+CO2↑
100 73
1g 5g×x%
100:73=1g:5g×x%
x%=14.6℅。
答:该盐酸中溶质的质量分数为14.6℅。
点评:本题的难点在于根据题中数据分析盐酸与碳酸钙的数量关系,在根据化学方程式计算时,要注意解题的步骤,即设、写、找、列、解、答。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 Ti + 2MgCl2,若要制得12 g钛,需要镁的质量是多少克?
Ti + 2MgCl2,若要制得12 g钛,需要镁的质量是多少克?