题目内容
我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu-Zn),它可以用来制造电器零件及日用品。小华利用一瓶稀盐酸和相关的仪器,测定黄铜样品的组成(不考虑铜中的其它杂质)。将30ml稀盐酸分别加入到10g黄铜粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
(1)从上表数据分析,小华用10g合金粉末共收集到氢气 g;
(2)求该合金中铜的质量分数。
| | 第一次 | 第二次 | 第三次 |
| 连续加入盐酸的体积/ml | 10 | 10 | 10 |
| 生成氢气的质量/g | 0.108 | 0.108 | 0.04 |
(2)求该合金中铜的质量分数。
(1)0.2g;(2)该合金中铜的质量分数为35%
试题分析:(1)第三次只收集到0.04g氢气,说明第三次加入时样品中的锌已经反应完,所以小华用10g合金粉末共收集到氢气1.08g+1.08g+0.04g=2.2g。
(2)解:设该合金中锌的质量为X。
Zn+2HCl=ZnCl2+H2↑
65 2
X 0.2g
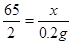 解得x=6.5g
解得x=6.5g该合金中铜的质量分数为:
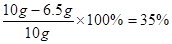
答:该合金中铜的质量分数为35%。
点评:这是化学反应联系方程式的计算题,这种题目是每年中考的压轴题,必考题,这类题目的难点在于把坐标曲线表示的意义和题干联系起来。

练习册系列答案
相关题目