题目内容
【题目】过氧化氢在生产生活中有广泛应用。实验小组对过氧化氢的某些性质进行研究。
Ⅰ、不稳定性
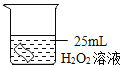
(1)如图所示进行实验,实验室用过氧化氢和二氧化锰制氧气的化学方程式为_____,属于_____反应(填反应类型)
(2)能用排水法收集O2的原因是_____。
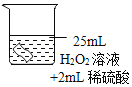
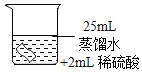
(3)探究温度对过氧化氢分解速率的影响同学们进行了如下的实验,实验数据如下表:
实验序号 | ① | ② | ③ |
H2O2溶液的浓度% | 30 | 30 | 30 |
H2O2溶液的体积/mL | 6 | 6 | 6 |
温度/℃ | 20 | 35 | 55 |
MnO2的用量/g | 0 | 0 | 0 |
收集O2的体积/mL | 0 | 1.9 | 7.8 |
反应时间 | 40min | 40min | 40min |
由此得出的结论是_____。
Ⅱ、腐蚀性
(査阅资料)H2O2溶液有腐蚀性。
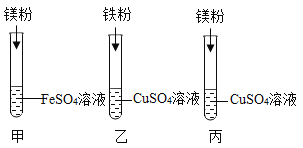
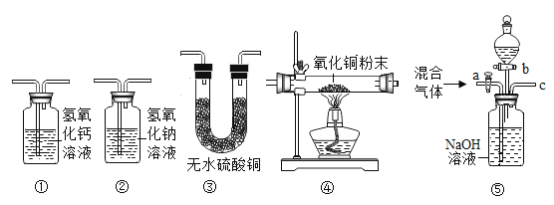
(进行实验)将铜片分别浸泡在3种溶液中进行实验,如下表。
编号 | ① | ② | ③ |
实验 |
|
|
|
一段时间后的现象 | 无明显变化 | 溶液变蓝,缓慢产生细小气泡 | 无明显变化 |
(解释与结论)
(4)实验①的作用是_____。
(5)铜片被腐蚀的反应如下,补全该反应的化学方程式:Cu+H2O2+H2SO4=CuSO4+_____。
(反思交流)
(6)某同学提出,实验②中,除发生(5)的反应外。还发生了一个反应导致有细小气泡产生,该反应的反应物为_____。
【答案】2H2O2![]() 2H2O+O2↑ 分解反应 氧气不易溶于水 在其他条件相同时,温度越高,过氧化氢分解的越快 对照实验 2H2O 过氧化氢
2H2O+O2↑ 分解反应 氧气不易溶于水 在其他条件相同时,温度越高,过氧化氢分解的越快 对照实验 2H2O 过氧化氢
【解析】
(1)过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,反应的化学方程式:2H2O2![]() 2H2O+O2↑,此反应属于分解反应;
2H2O+O2↑,此反应属于分解反应;
(2)能用排水法收集O2的原因是:氧气不易溶于水;
(3)探究温度对过氧化氢分解速率的影响,由表格得出的结论是:在其他条件相同时,温度越高,过氧化氢分解的越快;
(4)实验①的作用是对照实验;
(5)铜片被腐蚀的反应是:铜和过氧化氢和稀硫酸反应生成硫酸铜和水,根据反应前后原子个数、种类不变,可知为2H2O;
(6)该反应可能是放热反应。通过上述探究可知,温度较高条件下,过氧化氢能分解产生水的氧气。实验②中,除发生(5)的反应外。还发生了一个反应导致有细小气泡产生,该反应的反应物为过氧化氢。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】化学与生活息息相关,下列描述全部正确的一组( )
A化学与生活 | B化学与健康 |
生活中用洗洁精清洗油污的原理是乳化作用 实验室用品尝味道的方法区分食盐与白糖 | 老年人缺钙易得骨质疏松症 人体缺乏维生素A易得夜盲症 |
C化学与材料 | D化学与环境 |
塑料、天然橡胶、合成纤维都属于合成材料 玻璃钢、生铁、硬铝都属于合金 | 温室效应的形成主要与CO、CH4有关 酸雨形成主要与SO2、氮氧化合物有关 |
A. AB. BC. CD. D