题目内容
【题目】有一混合气体成分中可能含有水蒸气、一氧化碳、二氧化碳,某同学利用如图所示实验装置设计实验探究混合气体的成分并进行分离。请用适当的装置序号填空(装置可以重复使用,除杂试剂均足量)。
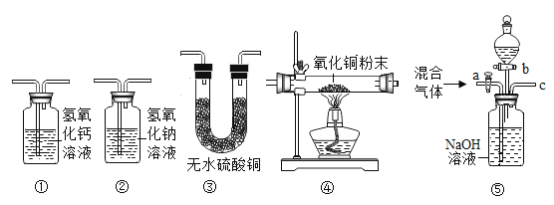
(1)检验混合气体中含有二氧化碳和水蒸气,应将混合气体依次通过装置__________。
(2)某同学将气体依次通过装置②④①,其中装置②的作用是________________________。装置①中发生反应的化学方程式为_________________________。出现________________现象,证明混合气体中含有一氧化碳。
(3)经检验该气体为一氧化碳和二氧化碳的混合气体,为实现两种气体的分离,小明又设计了如图⑤所示的装置(铁架台、铁夹等固定用装置已略去,a、b为活塞)
①当关闭活塞b,打开活塞a时,导管c处可分离得到_____________气体(写化学式),此时试剂瓶中发生的反应的有关化学方程式是_________________________。
②接下来关闭活塞a,再打开活塞b,要分离得到另一种气体,分液漏斗中应盛放的液体是___________(填写试剂名称)。
【答案】③① 除尽混合气体中的二氧化碳,防止对一氧化碳的检验造成干扰。 Ca(OH)2+CO2=CaCO3↓+H2O ④中固体会由黑色变成红色,①中的澄清石灰水变浑浊。 CO 2NaOH+CO2=Na2CO3+H2O 稀硫酸
【解析】
(1)检验水蒸气的存在用的是无水硫酸铜,检验二氧化碳的存在用的是澄清石灰水,为排除气体通过石灰水时易带出水蒸气的干扰,所以检验混合气体中含有二氧化碳和水蒸气时要先验水再验二氧化碳。故填:③①。
(2)将气体依次通过装置②④①是要检验混合气体中是否含有一氧化碳,②中的氢氧化钠能和二氧化碳反应,将其除尽,防止对一氧化碳的检验造成干扰,氧化铜和一氧化碳在加热的条件下反应生成的二氧化碳通入装置①中,①中的氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,反应的方程式为:Ca(OH)2+CO2=CaCO3↓+H2O,若混合气体中存在一氧化碳则一氧化碳会和氧化铜反应生成铜,即④中固体会由黑色变成红色,且生成的二氧化碳会使①中的澄清石灰水变浑浊。故填:除尽混合气体中的二氧化碳,防止对一氧化碳的检验造成干扰;Ca(OH)2+CO2=CaCO3↓+H2O;④中固体会由黑色变成红色,①中的澄清石灰水变浑浊。
(3)①二氧化碳和氢氧化钠反应生成碳酸钠和水,反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O。所以当关闭活塞b,打开活塞a时,可分离得到CO。故填:CO;2NaOH+CO2=Na2CO3+H2O。
②关闭活塞b,打开活塞a时,得到的是CO,所以关闭活塞b,打开活塞a时,要得到的是CO2,在第一步时二氧化碳和氢氧化钠反应生成碳酸钠和水,所以加入的液体需要和碳酸钠反应生成二氧化碳,因此我们加入的是稀硫酸,碳酸钠和硫酸反应可生成硫酸钠、水和二氧化碳,这样就收集到了二氧化碳。故填:稀硫酸。

【题目】某同学对“影响稀盐酸和大理石反应快慢的因素”进行探究.选取的药品:成分相同的粉末状大理石、块状大理石两种样品;浓度为16%、9%的稀盐酸.采用控制变量法设计实验方案,以5分钟内收集到CO2的质量作为判断依据.已知稀盐酸足量且样品中杂质不与稀盐酸反应,实验装置如图.读取电子天平的示数,据此计算生成的CO2的质量,记录的数据如表
实验序号 | 大理石 (各6g) | 稀盐酸的浓度 | 反应开始到5分钟产生CO2的质量 | 反应结束产生的CO2的质量 |
① | 块状 | 16% | 2.16g | 2.2g |
② | 块状 | 9% | 1.42g | 2.2g |
③ | 粉末 | 16% | 2.33g | 2.2g |
④ | 粉末 | 9% | 1.93g | m2 |
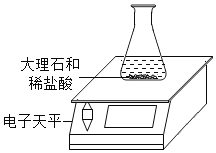
(1)稀盐酸的浓度对该反应快慢的影响:_____.
(2)实验过程中,通过观察如图装置中的哪一现象可判断反应结束_____.
(3)结合表格分析,实验④反应结束后m2的值_____.
(4)探究大理石的颗粒大小对该反应快慢的影响,其实验序号分别是_____.
(5)计算该大理石(6g)样品中含碳酸钙的质量为_____.
【题目】KOH溶液中含有H2O,K+,OH-能使无色酚酞试液变成红色.某化学兴趣小组想探究KOH溶液是无色酚酞试液变成红色的原因.
(提出问题)
KOH溶液中的什么成分是无色酚酞试液变红?
(猜想)
猜想1:KOH溶液中的H2O使无色酚酞试液变红.
猜想2:KOH溶液中的K+使无色酚酞试液变红.
猜想3:KOH溶液中的________(填化学式)使无色酚酞试液变红.
(实验探究)
实验操作 | 实验现象 | 结论 |
①用试管取少量蒸馏水,流入1-2滴无色酚酞试液 | 试管内溶液不变色 | 猜想 |
②用试管取少量KCl溶液,滴入1-2滴无色酚酞试液 | _______ | 猜想 |
③滴入1-2滴无色酚酞试液 | 试管内溶液变红 | _______ |
(讨论反思)有同学认为猜想①不需要验证就可以排除,你认为该同学的理由是________.
(拓展)①向Ba(OH)2溶液中滴入几滴无色酚酞试液,观察到的现象是___;②KOH应___保存.
【题目】某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0g石灰石样品,把25.0g一定质量分数的稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:
实验次数 | 1 | 2 | 3 | 4 | 5 |
稀盐酸的累计加入量 | 5.0g | 10.0g | 15.0g | 20.0g | 25.0g |
剩余固体的质量 | 1.5g | 1.0g | 0.5g | 0.2g | X |
(1)表中X的值为 。
(2)样品中碳酸钙的质量分数为 。
(3)求所用稀盐酸的溶质质量分数是多少?
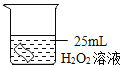
【题目】过氧化氢在生产生活中有广泛应用。实验小组对过氧化氢的某些性质进行研究。
Ⅰ、不稳定性
(1)如图所示进行实验,实验室用过氧化氢和二氧化锰制氧气的化学方程式为_____,属于_____反应(填反应类型)
(2)能用排水法收集O2的原因是_____。
(3)探究温度对过氧化氢分解速率的影响同学们进行了如下的实验,实验数据如下表:
实验序号 | ① | ② | ③ |
H2O2溶液的浓度% | 30 | 30 | 30 |
H2O2溶液的体积/mL | 6 | 6 | 6 |
温度/℃ | 20 | 35 | 55 |
MnO2的用量/g | 0 | 0 | 0 |
收集O2的体积/mL | 0 | 1.9 | 7.8 |
反应时间 | 40min | 40min | 40min |
由此得出的结论是_____。
Ⅱ、腐蚀性
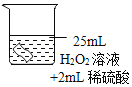
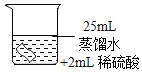
(査阅资料)H2O2溶液有腐蚀性。
(进行实验)将铜片分别浸泡在3种溶液中进行实验,如下表。
编号 | ① | ② | ③ |
实验 |
|
|
|
一段时间后的现象 | 无明显变化 | 溶液变蓝,缓慢产生细小气泡 | 无明显变化 |
(解释与结论)
(4)实验①的作用是_____。
(5)铜片被腐蚀的反应如下,补全该反应的化学方程式:Cu+H2O2+H2SO4=CuSO4+_____。
(反思交流)
(6)某同学提出,实验②中,除发生(5)的反应外。还发生了一个反应导致有细小气泡产生,该反应的反应物为_____。
【题目】某研究小组在学习氧气的化学性质时发现:铁丝、木炭燃烧没有火焰,蜡烛(主要成分是石蜡)燃烧却有明亮的火焰.该小组同学进行了如下探究.
(1)写出蜡烛燃烧的文字表达式:______.
(2)探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示).由此可知:蜡烛燃烧产生的火焰是由___(填“固态”或“气态”)物质燃烧形成的.

物质 | 熔点╱℃ | 沸点╱℃ | 燃烧时温度╱℃ |
石蜡 | 50至70 | 300至550 | 约600 |
铁 | 1535 | 2750 | 约1800 |
钠 | 97.8 | 883 | 约1400 |
(3)探究二:物质燃烧产生火焰的根本原因是什么?
(查阅资料)
由该表可知:物质燃烧能否产生火焰与其__(填“熔点”或“沸点”)和燃烧时温度有关.通过上表中石蜡、铁的数据对比,你认为物质燃烧时,什么情况下能产生火焰,由此推测:钠在燃烧时,__(填“有”或“没有”)火焰产生.
(4)根据硫在空气或氧气中燃烧的实验事实,请你推测硫沸点___硫燃烧时的温度(填“>”或“<”或“=”) .