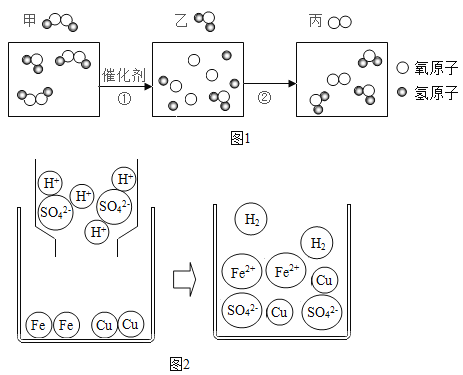
题目内容
【题目】碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如下:
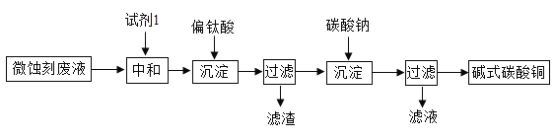
(1)加入试剂1的目的是除去废液中的酸性物质,试剂1最好选用__________(填序号)。
aFe2O3bCaCO3cCuO
(2)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,反应的化学方程式为:6Na2CO3+3Fe2(SO4)3+6H2O=2NaFe3(OH)6(SO4)2+6CO2↑+5__________ 。
(3)加入Na2CO3沉淀时,反应液pH对产品中的SO42- 含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在_________。
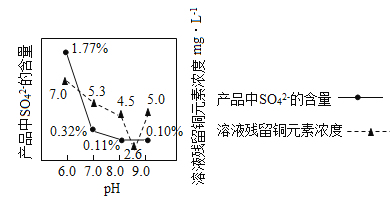
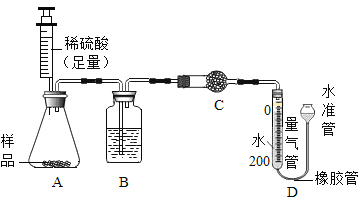
(4)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O。某研究小组设计如图实验装置测定其中CuCO3的质量分数(不考虑植物油中溶解CO2产生的影响)。
实验步骤如下:
a.连接装置并________;
b.准确称量样品的质量1.2g;
c.装药品,调节量气装置两边液面相平,读取量气管刻度为10mL;
d.向锥形瓶内加入50mL(足量)的稀硫酸,充分反应;
e.冷却到室温;
f.再次调节量气装置两边液面相平,读取量气管刻度为172mL。
①请将上述实验步骤补充完整;
②装置B的作用是 _________,C中的试剂是 _____________(填字母序号);
a碱石灰 b浓硫酸 c无水硫酸铜
③步骤f中调节液面相平的操作是将水准管 _____________(填“缓慢上移”或“缓慢下移”)。
④若标准状况下,每44g二氧化碳的体积为22.4L。根据实验数据计算产品中CuCO3的质量分数_______(写出计算过程。结果保留到0.1%)
⑤若其他操作均正确,仅因下列因素可使测定结果偏小的是_______________(填字母序号);
A量气管中未加植物油 B步骤c中平视刻度,步骤f中俯视读数
C硫酸的用量不足 D步骤f中没有调节量气装置两边液面相平,直接读数
【答案】C Na2SO4 8.5 检查装置气密性 干燥CO2 C 缓慢下移 51.7% ABCD
【解析】
(1)加入碳酸钙、氧化铁会引入新杂质钙离子铁离子,加入氧化铜,不会引入新杂质,且能去除废液中的酸性物质,故选:C。
(2)根据质量守恒,对于化学反应6Na2CO3+3Fe2(SO4)3+6H2O=2NaFe3(OH)6(SO4)2+6CO2↑+5()反应前后原子种类数目不变,反应前12Na、6C、60O、6Fe、9S、12H,反应后2Na、6C、40O、6Fe、4S、12H,故5()含10Na、5S、20O,故填:Na2SO4。
(3)由题可知pH为8.5时,溶液残余铜元素最少,产品硫酸根离子最低,故选:8.5。
(4)①气体制备连接好装置一定要检查气密性,故填:检查装置气密性。
②装置B的作用是去除二氧化碳水蒸气,起干燥作用,C检验水蒸气是否去除干净,可加无水硫酸铜,遇水会变蓝,故填:干燥CO2;C。
③D中收集完二氧化碳后左端液面下降,右端上升,调节液面相平的操作是将水准管缓慢下移,故填:缓慢下移。
④若标准状况下,每44g二氧化碳的体积为22.4L,收集到量气管内气体172mL-10mL-50mL=112mL=0.112L,二氧化碳质量为![]() ,设CuCO3的质量分数为x
,设CuCO3的质量分数为x
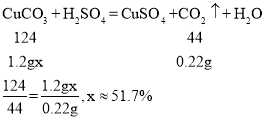
故填:51.7%。
⑤若其他操作均正确,仅因下列因素可使测定结果偏小:
A、量气管中未加植物油,二氧化碳溶解导致结果偏小,正确符合题意。
B、步骤c中平视刻度,步骤f中俯视读数,导致读数偏小,二氧化碳体积偏小,测量结果偏小,正确符合题意。
C、硫酸的用量不足碳酸铜不能完全反应,碳酸铜质量结果偏小,正确符合题意。
D、步骤f中没有调节量气装置两边液面相平,直接读数,二氧化碳气体体积被压缩,二氧化碳体积偏小,结果偏小,符合题意。
故选:ABCD。

【题目】(1)请结合如图所示实验回答问题:
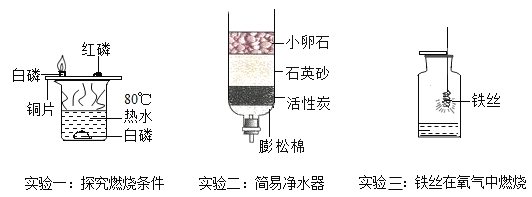
①实验一铜片上的白磷燃烧红磷不燃烧,说明燃烧的条件之一是______。
②实验二活性炭具有______、过滤作用。
③实验三集气瓶中水的作用是______。
(2)下列各组物质的鉴别或除杂方法![]() 括号内是杂质
括号内是杂质![]() 均正确的是______
均正确的是______![]() 用字母作答
用字母作答![]() 。
。
选项 | 物质 | 方法 |
A |
| 通过灼热的氧化铜 |
B |
| 加无色酚酞试液 |
C |
| 加水溶解、过滤 |
D |
| 加入适量的氢氧化钠溶液、过滤 |