题目内容
今有氢氧化钠、碳酸氢钠和与其他物质都不反应,受热也不分解的杂质组成的固体混合物17.110g,放入密闭容器中加热至250℃,经充分反应后,将容器中的气体通入过量的澄清石灰水中得到白色沉淀2.500g;当容器中的残留固体冷却到室温后,全部溶于水制成50.00ml溶液,从中取出10.00ml,恰好可与含HCl 1.825g的盐酸溶液25.00毫升中和至中性,求原混合物中含杂质的质量分数?
2.98%
解析试题分析:氢氧化钠、碳酸氢钠放入密闭容器中加热至250℃,氢氧化钠与碳酸氢钠反应生成碳酸钠和水,过量的碳酸氢钠分解生成碳酸钠、水和二氧化碳;生成的二氧化碳与能澄清石灰水生成碳酸钙沉淀,因此,利用沉淀碳酸钙的质量可计算放出气体二氧化碳的质量,再由二氧化碳的质量可计算出分解的碳酸氢钠的质量及生成的碳酸钠的质量;根据溶液的均一性,从50mL溶液取出10mL溶液时,溶液中溶质质量也为原溶质质量的五分之一;碳酸钠溶液呈碱性,与盐酸完全反应生成氯化钠和水,溶液呈中性;利用反应消耗盐酸的质量计算出加热后残留固体中碳酸钠的质量,用其质量减去碳酸氢分解产生的碳酸钠,所得碳酸钠质量即为氢氧化钠与碳酸氢钠反应所生成碳酸钠质量,由此计算混合物中氢氧化钠与碳酸氢钠的质量;最后使用混合物的质量减去氢氧化钠和碳酸氢钠的质量即可求得混合物中杂质质量,杂质质量与混合物质量比求出混合物中所含杂质的质量分数。
由题意可知NaHCO3过量,NaOH与CO2反应和NaOH与NaHCO3直接反应所生成的Na2CO3总质量是不变的,取NaHCO3计算更简便,有关反应如下:
NaOH+NaHCO3=Na2CO3+H2O ①
2NaHCO3 Na2CO3+CO2↑十H2O↑ ②
Na2CO3+CO2↑十H2O↑ ②
CO2+Ca(OH)2=CaCO3↓+H2O ③
Na2CO3+2HCl=2NaCl+H2O+CO2↑ ④
(1)设反应②分解的NaHCO3质量为x,分解产生的Na2CO3质量为y,由②③有:
2NaHCO3~Na2CO3~CaCO3
168 106 100
x y 2.500g
x= = 4.200g y=
= 4.200g y= = 2.650g
= 2.650g
(2)残留物全部中和至中性需HCl的质量为: ×50.00毫升 = 9.125g
×50.00毫升 = 9.125g
设残留物中Na2CO3的总质量为z,由④有:
Na2CO3~2HCl
106 73
z 9.125g =
= z=13.250g
z=13.250g
反应④产生的Na2CO3质量为 13.250g—2.650g=10.600g
10.600克Na2CO3是原混合物中的NaOH(设质量为a)和除发生分解反应之外的NaHCO3(设质量为b)恰好反应生成的,它们的质量关系是:
NaOH~NaHCO3~Na2CO3
40 84 106
a b 10.600g
a=4.00g, b=8.400g
杂质的质量分数为 ×100% ≈ 2.98%
×100% ≈ 2.98%
答:略
考点:根据化学反应方程式的计算;酸的化学性质;碳酸钠、碳酸氢钠与碳酸钙;质量守恒定律及其应用

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案长期使用的水壶底部结有一层水垢,其主要成分是碳酸钙和氢氧化镁,为较准确测定水垢中氢氧化镁的含量,实验小组分别取三份同样的水垢样品各7.00g,利用如图所示装置连续进行三次实验,并将每次实验中装置B的质量变化记录于下表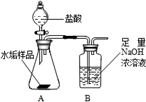
| | 第一次 | 第二次 | 第三次 | 平均值 |
| B装置增加的质量 | 2.17 | 2.22 | 2.21 | |
(1)第一次实验测得数据较低的原因是___________;
(2)平均每份水垢样品中碳酸钙的质量为___________克.