题目内容
(9分)火力发电厂用石灰石泥浆吸收废气中的二氧化硫以防止污染环境,其反应方程式为:
2CaCO3(粉末)+2SO2+O2==2CaSO4+2CO2。
(1)若100克废气中含6.4克二氧化硫,则处理100克这种废气需含碳酸钙(CaCO3)80%的
石灰石多少克。
(2)处理上述100克废气,可得到含CaSO485%的粗产品多少克。
设需含CaCO380%的石灰石的质量为x,则含纯物质CaCO3的质量为80%×x.又设生成纯CaSO4质量为y.
2CaCO3+2SO2+O2═2CaSO4+2CO2
200 128 272
80%×x 6.4g y
6.4g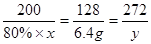 解得:x=12.5g y=13.6g
解得:x=12.5g y=13.6g
可得到含CaSO485%的粗产品的质量是: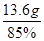 =16g
=16g
答:(1)需含碳酸钙(CaCO3)80%的石灰石12.5克.
(2)处理上述100克废气,可得到含CaSO485%的粗产品16克.
解析试题分析:首先要明确在利用化学方程式进行计算用料和产量时,由于化学方程式表示的是纯净物质之间的质量关系,利用公式:纯度= ×100%%,找到已知量和未知量.最后根据化学方程式计算的步骤、格式,结合着不纯物质和纯物质之间的相互转化方法,列出比例式求解即可.
×100%%,找到已知量和未知量.最后根据化学方程式计算的步骤、格式,结合着不纯物质和纯物质之间的相互转化方法,列出比例式求解即可.
考点:根据化学反应方程式的计算

练习册系列答案
相关题目
小英同学为了测定某地区石灰石样品中碳酸钙的质量分数,取该样品15g,现将75mL的稀盐酸分三次加入石灰石样品中,每次充分反应后测得生成气体的质量,实验数据如下表:
| 实验 | 第一次 | 第二次 | 第三次 |
| 加入稀盐酸的量/mL | 25 | 25 | 25 |
| 生成气体的质量/g | 2.2 | m | 1.1 |
(1)m的值是 g.
(2)求该样品中碳酸钙的质量分数(保留一位小数).
下图是胃得乐牌胃药的部分标识。胃药中所含的物质能中和胃里过多的胃酸(主要是盐酸)。某患者按标识上的服用方法服药三天后病情好转。计算患者在三天内所服用的此胃药中(计算结果取整数):
| 胃得乐牌 功能:主治胃酸过多引起的胃病 成分:每片含氢氧化镁250 mg 服用方法:每日三次,每次2片 |
(1)所含氢氧化镁的质量为____________ mg。
(2)理论上可中和胃酸中的HCl的质量为____________ mg。