题目内容
(3分)现有一瓶久置的过氧化氢溶液(标签如图所示)。已知过氧化氢溶液在存放过程中会缓慢分解。取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是33.8g,将杯内剩余物质过滤、洗涤、干燥后得滤渣3g。
请计算:
(1)现该瓶溶液的溶质质量分数。
(2)用该瓶溶液配制100g溶质质量分数为3%的过氧化氢溶液需要加入水的质量。
(1)20%;(2)85g
解析试题分析:(1) [解] 生成氧气的质量为:34g+3g-33.8g =" 3.2g"
设:取出的34 g过氧化氢溶液中含H2O2的质量为x
2H2O2 2H2O + O2↑
2H2O + O2↑
68 32
x 3.2g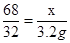
x=6.8g
该过氧化氢溶液中溶质质量分数为: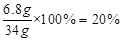
(2)设配制100g溶质质量分数为3%的过氧化氢溶液需该溶液质量为y
100g × 30% = 20%y y = 15g
则需加水的质量为:100g-15g =" 85g"
答:需加水的质量为85g。
考点:有关溶液的计算、化学方程式的计算

练习册系列答案
相关题目
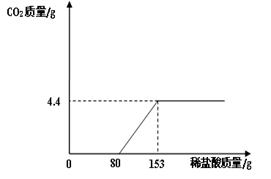
某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
| 稀硫酸用量 | 剩余固体质量 | 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | mg | 第四次加入10g | 1.0g |
| 第二次加入10g | 2.0g | 第五次加入10g | 0.6g |
| 第三次加入10g | 1.5g | 第六次加入10g | 0.6g |
(2)第六次实验后,所得溶液中硫酸镁的质量分数(要求写出计算过程,结果保留到0.1%)