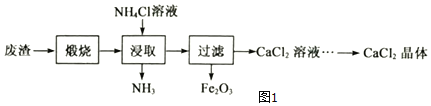
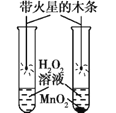
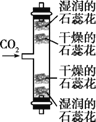
题目内容
【题目】依据所学的化学知识回答:
(1)人体缺乏_____会引起夜盲症.
(2)铝、铁都是生活中常使用的金属,但铝比铁更耐腐蚀,其原因是(用化学方程式表示)_____.
(3)测定溶液的酸碱度最简便的方法是使用_____.
(4)为了满足尖端技术发展的需要,人们综合不同材料的优点,制成了比原来单一材料的性能优越得多的_____材料,如玻璃钢、碳纤维.
(5)如图所示是简易净水器,该装置不能将硬水软化的原因是_____.
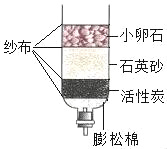
【答案】维生素A 4Al+3O2═2Al2O3 pH试纸 复合 该装置能除去不溶性杂质和某些可溶性的杂质(如颜色、异味)(或该装置不能除去水中的钙镁化合物)
【解析】
(1)人体缺乏维生素A易患夜盲症;故填:维生素A;
(2)铝具有良好的抗腐蚀性能是因为:铝能与空气中的氧气反应生成致密的氧化铝保护膜,方程式是4Al+3O2═2Al2O3;故填:4Al+3O2═2Al2O3;
(3)测定溶液酸碱度的最简单的方法是使用pH试纸;故填:pH试纸;
(4)复合材料集中了合成材料的优点,具有综合性能更优异的特点.故填:复合;
(5)该装置中的小卵石、石英砂等只能除去难溶性杂质,活性炭可以吸附色素和异味,无法除去可溶性杂质,所以不能将硬水软化;故填:该装置能除去不溶性杂质和某些可溶性的杂质(如颜色、异味)(或该装置不能除去水中的钙镁化合物).

【题目】设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到目的的是( )
编号 | A | B |
实验设计 |
|
|
实验目的 | 探究同种物质在不同溶剂中的溶解性 | 探究氧气是燃烧的条件之一 |
编号 | C | D |
实验设计 |
|
|
实验目的 | 探究二氧化锰的催化作用 | 探究CO2的密度和石蕊花变红的原因 |
A. AB. BC. CD. D
【题目】兴趣小组同学对“氢氧化钠溶液与稀硫酸混合是否发生了化学反应”进行了如下探究:
【提出问题】氢氧化钠溶液与稀硫酸混合是否发生了化学反应?
【猜想与假设】
a:二者混合发生了化学反应;
b:二者混合没有发生化学反应。
【设计并实验】
实验操作 | 实验现象 | |
甲同学 | 向盛有10mL一定溶质质量分数的氢氧化钠溶液的烧杯中,用胶头滴管慢慢滴入1-2滴稀硫酸,振荡,同时测定溶液的pH | 溶液pH减小但仍大于7 |
乙同学 | 向盛有10mL一定溶质质量分数的氢氧化钠溶液的烧杯中,先滴入几滴无色酚酞试液,然后再加入稀硫酸 | 溶液由红色变为无色 |
【得出结论】氢氧化钠溶液与稀硫酸发生了化学反应。
(1)乙同学认为甲的实验设计不合理,原因是_____________,改进的方法是____________;根据改进后的实验现象说明二者混合后发生了化学反应,写出氢氧化钠溶液与稀硫酸反应的化学方程式__________;甲同学也认为乙的实验设计也不合理,你是否赞同,说出你的理由___________。
【思考与交流】
丙同学在绝热装置中,向分别盛有10mL10%氢氧化钠溶液加入不同体积某浓度的稀硫酸,充分混合后溶液的温度变化曲线如图(混合前稀硫酸和氢氧化钠溶液均为18℃)。
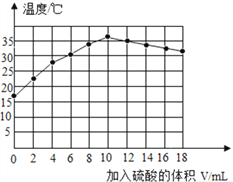
(2)根据图示分析,稀硫酸和氢氧化钠的反应是__________(填吸热、放热)反应,加入稀硫酸_________mL时,二者恰好完全反应.
【题目】某化学兴趣小组在一次实验中进行如图所示的实验:
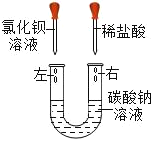
此时观察到U形管左右两侧产生的现象是不同的;实验后,小组同学充分振荡U形管。发现管内仍有白色固体残留。将固体分离后,同学们对滤液成分产生浓厚的兴趣,于是进行了进一步的探究活动
(1)(提出问题)滤液中可能含有哪些溶质?
(猜想与假设)猜想一:溶质为NaCl
猜想二:溶质为NaCl和BaCl2
猜想三:溶质为NaCl、BaCl2和HCl
你认为以上猜想_____不合理;理由是_____(请用化学方程式表示);请写出你的猜想_____。
(2)(实验探究)小红为了验证滤液成分,取滤液于试管中,向其中滴加少量的硫酸钠溶液,观察到无明显现象。由此得出结论:猜想一成立。小刚认为小红的结论是否严密_____(填“严密”或“不严”)。
为了验证你的猜想,请填写下表:
实验操作 | 实验现象 | 实验结论 |
取滤液适量于试管中,向其中滴加适量_____溶液 | 溶液由无色变为红色 | 你的猜想成立 |
(3)(归纳与总结)通过上述实验,我们能够总结出:在确定化学反应后所得溶液溶质成分时,除了考虑生成物外,还需要考虑_____。