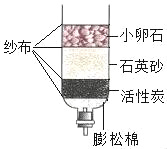
题目内容
【题目】某工厂产生的废渣主要成分是含钙的化合物(杂质为Fe2O3)。用该废渣制取CaCl2晶体(CaCl2xH2O)并进行组成测定,其制取的流程如图1所示:
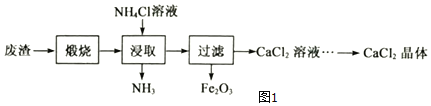
已知:NH4Cl溶液显酸性,且浓度越高酸性越强
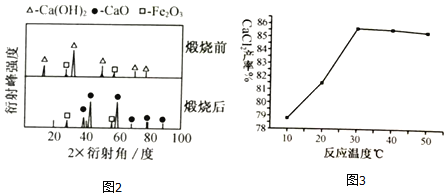
(1)XRD图谱可用于判断某固态物质是否存在。图2为煅烧前后废渣的XRD图谱。写出煅烧时发生的化学反应方程式_____。
(2)浸取时需连续搅拌,其目的是_____;生成的NH3能使湿润的红色石蕊试纸变_____色。
(3)在其它条件相同的情况下,CaCl2的产率随浸取温度的变化如图3所示。则宜选择的浸取温度为_____0C左右。
(4)若使用过量浓度较高的NH4Cl溶液,则所得CaCl2溶液中会含有NH4Cl、_____(填化学式)等杂质。
(5)测定晶体(CaCl2xH2O)的组成:
a 称取14.7000g CaCl2晶体于锥形瓶内,加入适量蒸馏水。使其全部溶解。
b 再向其中加入足量的Na2CO3溶液,静置。
c _____、_____、干燥、称量,得到10.0000g固体。
①通过计算,确定x的值为_____。
②判断步骤b中沉淀完全的方法是:_____,则说明已沉淀完全;若沉淀不完全,则测得的x值比实际值_____(填“偏大”、“偏小”或“不变”)。
【答案】CaCO3![]() CaO+CO2↑ 使反应物接触更充分,提高原料利用率 蓝 30 FeCl3 过滤 洗涤 x=2 静置,取上层清液滴加碳酸钠溶液,无白色沉淀产生 偏大
CaO+CO2↑ 使反应物接触更充分,提高原料利用率 蓝 30 FeCl3 过滤 洗涤 x=2 静置,取上层清液滴加碳酸钠溶液,无白色沉淀产生 偏大
【解析】
(1)碳酸钙高温煅烧生成氧化钙与二氧化碳,化学方程式是:CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(2)浸取时需连续搅拌,其目的是:使氧化钙与水充分反应生成氢氧化钙,再与氯化铵反应;氨气溶于水形成氨水显碱性,能使湿润的红色石蕊试纸变蓝色;
(3)通过分析图示可知,30℃左右CaCl2的产率最高;
(4)NH4Cl溶液显酸性,且浓度越高酸性越强酸与氧化铁反应生成氯化铁,杂质是氯化铁:FeCl3;
(5)①设晶体样品中CaCl2的质量为a,则

![]() =
=![]()
a=11.1g
所以水的质量=14.7g-11.1g=3.6g
由CaCl2xH2O晶体中CaCl2和水的质量比可列式:
![]() =
=![]()
x=2;
②沉淀完全说明溶液中不含有氯化钙,如果向上层清液中滴加碳酸钠,没有沉淀产生,说明已沉淀完全,若沉淀不完全,计算的氯化钙质量小,水的质量多,所以x值偏大。

【题目】烧杯内原有某物质,向其中加入物质X,X的质量与变量Y的关系如图,下列一定能正确反应X、Y对应关系的是
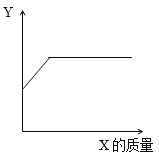
选项 | 烧杯内原有的物质 | X | Y |
A | 氯化钠溶液 | 氯化钠固体 | 溶液中溶质的质量分数 |
B | 水 | 硝酸铵固体 | 溶液的温度 |
C | 硫酸铜溶液 | 铁粉 | 溶液中溶质的质量 |
D | 稀硫酸 | 氧化铜 | 溶液中氧元素的质量 |
A. AB. BC. CD. D