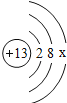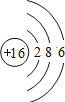题目内容
【题目】乙烯(C2H4)是石油炼制的重要产物之一.常温常压时,乙烯是一种气体,它与另一种气体组成的混合物中碳元素的质量分数为87%,则另一种气体可能是( )
A. H2B. CH4C. C2H2D. CO
【答案】C
【解析】
乙烯中,碳元素的质量百分比=![]() ×100%=85.7%,
×100%=85.7%,
A、H2中不含有碳元素,碳元素的质量百分比为0;
B、CH4中碳元素的质量百分比=![]() ×100%=75%;
×100%=75%;
C、C2H2中碳元素的质量百分比=![]() ×100%=92.3%;
×100%=92.3%;
D、CO中碳元素的质量百分比=![]() ×100%=42.9%;
×100%=42.9%;
因为,混合气体的碳元素质量分数为87%,而乙烯<87%,所以,另一种气体的含碳量一定要>87% 才能使混合气体中碳元素质量分数大于87%;
故选:C。

【题目】烧杯内原有某物质,向其中加入物质X,X的质量与变量Y的关系如图,下列一定能正确反应X、Y对应关系的是
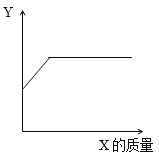
选项 | 烧杯内原有的物质 | X | Y |
A | 氯化钠溶液 | 氯化钠固体 | 溶液中溶质的质量分数 |
B | 水 | 硝酸铵固体 | 溶液的温度 |
C | 硫酸铜溶液 | 铁粉 | 溶液中溶质的质量 |
D | 稀硫酸 | 氧化铜 | 溶液中氧元素的质量 |
A. AB. BC. CD. D
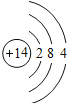
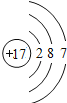
【题目】如图是第三周期部分元素的原子结构示意图,请根据题目要求填写下列空白.
第三周期 | Na | Al | Si | S | Cl |
(1)铝原子的质子数为_____,最外层电子数为_____,在化学反应中易失电子.
(2)当图中X=0时,则该粒子结构示意图表示的是_____;(填粒子符号)
(3)由第三周期元素组成AB4型化合物,其化学式可能是_____.
(4)图中同一周期元素原子的一条变化规律是_____.
【题目】食盐是人类生存的必需品,获取食盐的途径有多种。
(1)开采岩盐。地下盐层含氯化钠、硫酸钠等物质,构成硫酸钠的阴离子是_____ (填符号)。 除去氯化钠溶液中的硫酸钠应选用的试剂是_____(填化学式)溶液。
(2)熬制井盐。用井中产生的天然气作为燃料熬制井盐。CH4燃烧的化学方程式是_____。
(3)海水晒盐。某地海水中主要物质的含量见表。 该海水中氯化钠的质量分数为_____,配制某氯化钠溶液需 85mL 水,应选用量筒的规格为_____mL。
物质 | 每 100g 海水所含质量(g) |
水 | 96.5 |
氯化钠 | 2.7 |
硫酸钠 | 0.2 |
…… | …… |
(4)松花蛋的制作过程也需用氯化钠,还有生石灰、纯碱等,制作料泥时将上述原料加入水中,混合均匀即可。
从物质分类的角度看,该料泥是_____物,料泥中的“纯碱”是_____(填物质的名称) 的俗称;原料中可以做干燥剂的物质是_____(填化学式),它与水发生反应的化学方程式为_____,该反应过程_____热量(填“放出”或“吸收”)。
【题目】食盐是人类生存的必需品,获取食盐的途径有多种。
(1)开采岩盐。地下盐层含氯化钠、硫酸钠等物质,构成硫酸钠的阴离子是_____ (填符号)。 除去氯化钠溶液中的硫酸钠应选用的试剂是_____(填化学式)溶液。
(2)熬制井盐。用井中产生的天然气作为燃料熬制井盐。CH4燃烧的化学方程式是_____。
(3)海水晒盐。某地海水中主要物质的含量见表。 该海水中氯化钠的质量分数为_____,配制某氯化钠溶液需 85mL 水,应选用量筒的规格为_____mL。
物质 | 每 100g 海水所含质量(g) |
水 | 96.5 |
氯化钠 | 2.7 |
硫酸钠 | 0.2 |
…… | …… |
(4)松花蛋的制作过程也需用氯化钠,还有生石灰、纯碱等,制作料泥时将上述原料加入水中,混合均匀即可。
从物质分类的角度看,该料泥是_____物,料泥中的“纯碱”是_____(填物质的名称) 的俗称;原料中可以做干燥剂的物质是_____(填化学式),它与水发生反应的化学方程式为_____,该反应过程_____热量(填“放出”或“吸收”)。