��Ŀ����
����Ŀ���ƾ��ֳ�Ϊ�Ҵ���������������������������Ҳ��һ�����ȼ�ϡ��õ��������Ҵ��Ļ�ѧ��Ӧ����ʽ�ǣ�(C6H10O5)n�� nH2O ![]() 2nCH3CH2OH��2nCO2��
2nCH3CH2OH��2nCO2��
[ע��(C6H10O5)n����Է���������162n ]�����㣨�������1λС������
��1��CH3CH2OH����Է��������� ��
��2��100�K���������Ͽ����Ƶ��Ҵ��������Ƕ��٣�
��3���������Ƽݳ��ı�������ѪҺ���Ҵ���������80mg/L����������ѪҺ![]() ռ�������ص�10%������ѪҺ���ܶ��ǣ�1kg/L������
ռ�������ص�10%������ѪҺ���ܶ��ǣ�1kg/L������
����һ������Ϊ60kg�ļ�ʻԱѪҺ�������Ҵ������������ܳ������٣�
�������н���൱��![]() ��������Ϊ50%�İƵ������Ƕ��٣�
��������Ϊ50%�İƵ������Ƕ��٣�
���𰸡���1��46
��2���⣺��100kg���������Ͽ����Ƶ��Ҵ���������x
��C6H10O5��n+2NH2O![]() 2NCH3CH2OH+2NCO2��
2NCH3CH2OH+2NCO2��
162n 92n
100kg x
![]()
x��56.8kg
��3���⣺����һ������Ϊ60kg�ļ�ʻԱ��ѪҺ�о����������ܳ�������Ϊy
y=(60kg��10%��1kg/L)��80mg/L
=480mg
���൱����������50%�İƵ�����Ϊz
Z=480mg��50%
=960mg
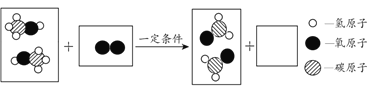
����������1��������Է����������ڸ�ԭ�ӵ����ԭ������֮�ͽ��н��
��2�����û�ѧ����ʽ�����ݵ��۵���������ƾ���������
��3������������������Լ�����ѪҺ���Ҵ��ĺ���������Ҵ�����������
������������������=![]() ��100%��
��100%��
�⣺��1��CH3CH2OH����Է�������=12��2+1��6+16=46��
�⣺��100kg���������Ͽ����Ƶ��Ҵ���������x
��C6H10O5��n+2NH2O![]() 2NCH3CH2OH+2NCO2��
2NCH3CH2OH+2NCO2��
162n 92n
100kg x
![]()
x��56.8kg
��3���⣺����һ������Ϊ60kg�ļ�ʻԱ��ѪҺ�о����������ܳ�������Ϊy
y=(60kg��10%��1kg/L)��80mg/L=480mg
���൱����������50%�İƵ�����Ϊz
Z=480mg��50%=960mg
�ʴ�Ϊ��
��1��46��
��2��56.8kg��
��3����480mg����960mg��

����Ŀ�����������ܽ�����ߺ�A���ʵIJ����¶��ǵ��ܽ���ж�����˵����ȷ���ǣ�������
�¶�/�� | 0 | 20 | 40 | 60 | |
�ܽ��/g | A���� | 20 | 28 | 45 | 60 |
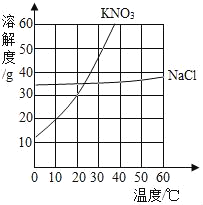
A. ����ͼ��֪��KNO3��NaCl���ܽ�Ⱦ�����A ���ʵ��ܽ��
B. 10��ʱ����40gNaCl����50gˮ�У�����ܽ⣬������Һ��NaCl�IJ�������Һ
C. ��30��ʱNaCl��KNO3����A���ʵı�����Һ��������10�棬������Һ����������������СΪ��KNO3��NaCl��A
D. 20��ʱ����KNO3��NaCl��A���ʸ�30g�ֱ����Ƴ�ǡ�ñ�����Һ��������Һ��������СΪA��KNO3��NaCl