题目内容
【题目】如图为A、B两种固体物质的溶解度曲线。
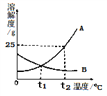
(1)t2℃时,100g水中溶解___gA物质恰好饱和,该饱和溶液中溶质的质量分数为_____。
(2)t2℃时,分别将恰好饱和的A、B两种物质的溶降温至t1℃,溶质的质量分数保持不变的是______。
【答案】 25 20% B
【解析】在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。(1) ![]() ,t2℃时,100g水中溶解25gA物质恰好饱和,该饱和溶液中溶质的质量分数为25g÷(25g+100g)×100%=20%;(2)t2℃时,分别将恰好饱和的A、B两种物质的溶降温至t1℃,B的溶解度变大,溶质不会析出,溶质的质量分数保持不变。
,t2℃时,100g水中溶解25gA物质恰好饱和,该饱和溶液中溶质的质量分数为25g÷(25g+100g)×100%=20%;(2)t2℃时,分别将恰好饱和的A、B两种物质的溶降温至t1℃,B的溶解度变大,溶质不会析出,溶质的质量分数保持不变。

 阅读快车系列答案
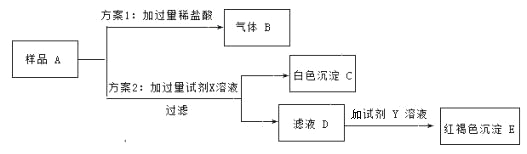
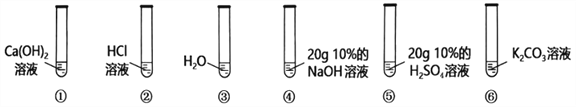
阅读快车系列答案【题目】学习氢氧化钠化学性质时,某化学兴趣小组设计以下实验,探究氢氧化钠与二氧化碳是否发生反应及所得溶液的溶质成分。
①从反应物减少角度探究氢氧化钠与二氧化碳是否反应。
实验操作如图所示,观察到软塑料瓶变瘪,认为氢氧化钠与二氧化碳反应了,反应的化学方程式为_____;一位同学认为此实验操作及现象不足以证明氢氧化钠与二氧化碳发生了反应,其理由是_____;小组同学进一步思考讨论后,他们用和甲相同的充满二氧化碳的软塑料瓶,加入_____,做了对照实验,完善了方案。

②从生成物角度探究氢氧化钠与二氧化碳是否反应,取上述方案C中的溶液少许,滴加_____,观察到有产生气泡,证明氢氧化钠与二氧化碳发生了反应。
③探究方案①中C的溶质成分
实验步骤 | 实验现象 | 实验结论 |
步骤一:取少量样品,滴加___________ | 产生白色沉淀 | 溶质成分为_____ |
步骤二:_____ | _____ |