题目内容
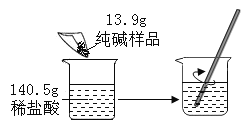
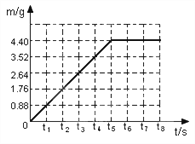
【题目】小明同学将13.9g含杂质氯化钠的纯碱样品与140.5g稀盐酸相混合,充分反应,测得反应生成气体的质量(m)与反应时间(t)变化的曲线如下图所示:
请计算:
(1)纯碱样品中碳酸钠的质量分数(计算结果保留一位小数);
(2)完全反应后所得溶液中溶质的质量分数。
【答案】(1)76.3% (2)10%。
【解析】(1)由曲线图可知,生成二氧化碳的质量为4.4g,设样品中的碳酸钠的质量为x,反应后可生成氯化钠的质量为y
Na2CO3+2HCl ==2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
![]() =
=![]() =
=![]() 得x=10.6g,y=11.7g
得x=10.6g,y=11.7g
纯碱样品中碳酸钠的质量分数=![]() =76.3%;
=76.3%;
(2)原样品中氯化钠的质量为13.9g-10.6g=3.3g,故反应后溶液中氯化钠的质量为3.3g+11.7g=15g,反应后溶液的质量=13.9g+140.5g-4.4g=150g,
完全反应后所得溶液中溶质的质量分数=![]() =10%;
=10%;
答:纯碱样品中碳酸钠的质量分数76.3%,反应后溶液中溶质的质量分数为10%;

练习册系列答案
相关题目