题目内容
【题目】水和溶液在生产生活中起着十分重要的作用。
(1)“直饮水机”可将自来水净化为饮用水,其内部使用的活性炭主要起______作用。实验室常用______方法降低水的硬度。
(2)C1O2是饮用水常用的消毒剂。制取C1O2的反应如下:C12+2NaC1O2=2C1O2+2X,则X的化学式为______。
(3)食盐水能导电是由于食盐溶于水形成______。
(4)如图是甲、乙两种不含结晶水的固体物质的溶解度曲线。
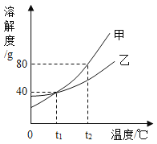
①t1℃时,甲物质的溶解度是_____g。
②t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是_____ (填“甲”或“乙”)物质的饱和溶液。
③t2℃时,将一瓶溶质质量分数为10%的乙溶液,蒸发掉60 g水后,溶质质量分数变为20%,则原溶液中溶质的质量为_____g。
【答案】吸附 蒸馏 NaCl 自由移动的离子 40 乙 12
【解析】
活性炭具有吸附性,可以吸附水中的色素和异味,硬水软化的方法是煮沸,根据质量守恒定律,反应前后原子个数相同,原子种类不变。
(1)“直饮水机”可将自来水净化为饮用水,活性炭具有吸附性,可以吸附水中的色素和异味,故其内部使用的活性炭主要起吸附作用。实验室常用蒸馏方法降低水的硬度。
(2)C1O2是饮用水常用的消毒剂。制取C1O2的反应如下:C12+2NaC1O2=2C1O2+2X,根据质量守恒定律,左边有4个氯原子,2个钠原子,4个氧原子,右边有2个氯原子,4个氧原子,故X的化学式为NaCl。
(3)溶液能导电是因为溶液中含有自由移动的离子,故食盐水能导电是由于食盐溶于水形成自由移动的离子。
(4)①t1℃时,甲物质的溶解度是40 g。
②t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,由于甲的溶解度随温度变化比乙快,故蒸发掉较多水的是乙物质的饱和溶液。
③设原溶质的质量为x,溶液的质量为y,则![]() ,
,![]() ,蒸发掉60 g水后,溶质质量分数变为20%,将
,蒸发掉60 g水后,溶质质量分数变为20%,将![]() 带入
带入![]() ,则
,则![]() ,故原溶液中溶质的质量为12g。
,故原溶液中溶质的质量为12g。

【题目】实验小组研究制备Cu(OH)2的条件并探究其稳定性。
(查阅资料)两种含铜化合物的部分性质如下表所示。
化合物 | Cu(OH)2 | Cu4(OH)6SO4 | CuO |
颜色 | 蓝色 | 绿色 | 黑色 |
在水中的溶解性 | 难溶 | 难溶 | 难溶 |
(进行实验)
实验1:室温下,取16%CuSO4溶液和4%NaOH溶液进行实验。
| 序号 | CuSO4溶液体积/mL | NaOH溶液体积/mL | 实验现象 |
1-1 | 2 | 2 | 产生浅绿色沉淀 | |
1-2 | 2 | 4 | 产生蓝色沉淀 混有少量浅绿色沉淀 | |
1-3 | 2 | 6 | 产生蓝色沉淀 |
实验2:将1-3所得混合物过滤,得到蓝色沉淀,将沉淀洗涤、干燥后置于恒温烘箱中,3h后观察并记录实验现象。
序号 | 2-1 | 2-2 | 2-3 | 2-4 | 2-5 |
烘箱温度/oC | 40 | 50 | 60 | 70 | 80 |
固体是否变黑 | 不变黑 | 不变黑 | 不变黑 | 变黑 | 变黑 |
实验3: 重复实验1-3,将所得混合物置于不同水浴温度下,记录实验现象。
序号 | 3-1 | 3-2 | 3-3 | 3-4 |
水浴温度/oC | 0 | 30 | 60 | 90 |
出现黑色沉淀的时间 | 1h | 3min | 25s | 2s |
(解释与结论)
(1)CuSO4溶液与NaOH溶液反应制Cu(OH)2的化学方程式为_____。
(2)实验1-1反应得到浅绿色沉淀的主要成分是______。
(3)由实验1
(4)实验2固体变黑的原因是_____(用化学方程式解释)。
(5)实验3的结论是_____。
(反思与评价)
(6)对比实验2和实验3,得出的结论是_____。