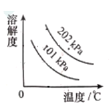
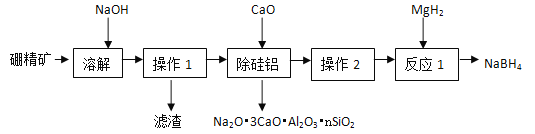
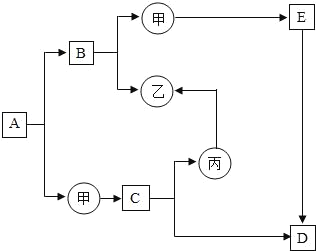
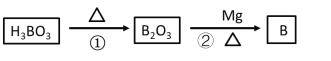题目内容
【题目】同学们做甲、乙两个盐跟盐反应的分组实验(见图)。
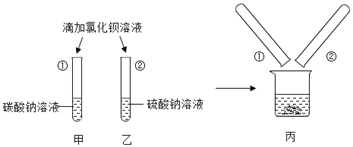
(1)甲组实验中观察到的现象是___。
(2)乙组实验中反应的化学方程式为___。
(3)实验结束后,甲、乙两组同学将全部的浊液集中倒进一个废液缸中(如图丙)。丙组同学对浊液进行过滤,探究滤液的成分。
(提出问题)滤液里除了NaCl外,还有什么物质?
(提出猜想)猜想Ⅰ:___;猜想Ⅱ:Na2SO4;猜想Ⅲ:Na2CO3;猜想Ⅳ:Na2CO3和Na2SO4
(实验探究)
探究方案 | 实验现象与结论 |
①若现象a只有白色沉淀,则猜想__成立。 ②若现象a只有__,则猜想Ⅲ和猜想Ⅳ可能成立。 | |
当现象b产生白色沉淀时,再向白色沉淀加入稀硝酸, ③若沉淀全部不溶解且无气泡产生,则猜想__成立; ④若沉淀全部溶解且__,则猜想Ⅲ成立; ⑤__且产生气泡,则猜想Ⅳ成立。 |
(拓展与思考)上述滤液的成分不可能出现的组合是BaCl2、Na2CO3和Na2SO4,原因是___。

【答案】产生白色沉淀 BaCl2+Na2SO4=BaSO4↓+NaCl BaCl2 Ⅰ 产生气泡 Ⅱ 有气泡产生 硫酸钡不溶于稀硝酸,碳酸钡能溶于稀硝酸,所以沉淀部分溶解 BaCl2、Na2CO3和Na2SO4在溶液中不能共存
【解析】
(1)氯化钡和碳酸钠反应生成碳酸钡白色沉淀和氯化钠,所以观察到产生白色沉淀;故填:产生白色沉淀;
(2)氯化钡与硫酸钠反应生成硫酸钡白色沉淀和氯化钠;故填:BaCl2+Na2SO4=BaSO4↓+NaCl
【提出猜想】
根据BaCl2与Na2CO3溶液的反应、BaCl2与Na2SO4溶液的反应,结合反应物质的过量情况,可以是氯化钡过量,还可以是碳酸钠或是硫酸钠过量,或是碳酸钠和硫酸钠都过量,故填:BaCl2;
【实验探究】
①只有氯化钡可以和硫酸反应生成白色沉淀硫酸钡,若现象a只有白色沉淀,则滤液里除了NaCl外,还有氯化钡,即猜想Ⅰ成立;故填:Ⅰ
②猜想Ⅲ和猜想Ⅳ中都含有碳酸钠,加入足量的稀硫酸会产生二氧化碳气体,故观察到产生气泡;故填:产生气泡
③若沉淀全部不溶解且无气泡产生,则只有硫酸钠,即猜想Ⅱ成立;故填:Ⅱ
④若只有碳酸钠,则碳酸钡沉淀能与硝酸反应生成硝酸钡、水和二氧化碳,沉淀全部溶解,并有气泡产生;故填:有气泡产生
⑤硫酸钡不溶于稀硝酸,碳酸钡能溶于稀硝酸,所以沉淀部分溶解且有气泡产生,猜想Ⅳ成立。
【拓展与思考】BaCl2、Na2CO3和Na2SO4在溶液中不能共存,所以上述滤液的成分不可能出现的组合是BaCl2、Na2CO3和Na2SO4,故填:BaCl2、Na2CO3和Na2SO4在溶液中不能共存。

【题目】某化学兴趣小组的同学学习“灭火器原理”后,设计了如下图所示实验,并对反应后瓶中残留废液进行探究。
(提出问题)废液中所含溶质是什么?
(猜想与假设)
猜想1:废液中的溶质是NaCl、Na2CO3和HCl
猜想2:废液中的溶质只有NaCl
猜想3:废液中的溶质是NaCl、HCl
猜想4:废液中的溶质是______。
(讨论与交流)
小明认为猜想I无需验证就知道是错误的,他的理由是_____(请用化学方程式说明)。
(实验与结论)
(1)小亮同学为验证猜想3,取少量废液装入试管中,然后滴入酚酞溶液,发现溶液不变色,于是小亮认为猜想3正确。你认为他的结论____(填“正确”或“错误”),理由是______________。
请你另设计实验方案验证猜想3:
实验步骤 | 实验现象 | 实验结论 |
__________________ | __________________ | 猜想3正确 |
(2)验证猜想4,可选择的试剂有____________。
A.酚酞溶液B.氢氧化钾溶液C.稀硫酸D.氯化钡溶液
(拓展与应用)若废液中的溶质是NaCl和HCl,根据盐酸的性质,无需另加试剂,只要对废液进行____操作,即可从废液中得到NaCl固体。