题目内容
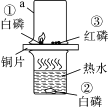
【题目】根据图所示的实验回答问题:

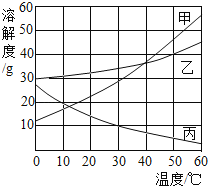
(1)甲实验是探究二氧化锰和溶液量对过氧化氢分解生成氧气质量的影响(固定仪器及测量装置已略去)。试管②中发生反应的化学方程式为________,放入试管③的物质应满足的条件是________。
(2)乙实验是在实验室制取蒸馏水,烧瓶中碎瓷片的作用是________。
蒸馏实验结束后,从AB瓶中分别取等量的液体,滴入等量的肥皂水后振荡,产生浮渣较少的是________(选填“A”或“B”)中液体。
(3)丙实验为氢气燃烧实验。实验结束时熄灭氢气的操作是________。
【答案】2H2O2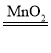 2H2O+O2↑ 10g10%的双氧水 防止暴沸 B 夹紧胶管(合理即可)
2H2O+O2↑ 10g10%的双氧水 防止暴沸 B 夹紧胶管(合理即可)
【解析】
(1)实验室利用过氧化氢在二氧化锰的催化下生成水和氧气,反应的化学方程式为2H2O2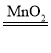 2H2O+O2↑ ;实验目的是探究二氧化锰和溶液量对过氧化氢分解生成氧气质量的影响 ,前两组是对比质量对反应速率的影响,后两组是探究二氧化锰对反应速率的影响,因此试管③ 应放入10g10%的双氧水;
2H2O+O2↑ ;实验目的是探究二氧化锰和溶液量对过氧化氢分解生成氧气质量的影响 ,前两组是对比质量对反应速率的影响,后两组是探究二氧化锰对反应速率的影响,因此试管③ 应放入10g10%的双氧水;
(2)圆底烧瓶底部受热,液体会爆沸,放入碎瓷片能治防止爆沸;蒸馏后的水是纯净物,属于软水,不含或含有少量的钙镁离子,因此很少产生浮渣;
(3)夹紧胶管可以隔绝氢气。

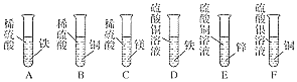
【题目】同学们做甲、乙两个盐跟盐反应的分组实验(见图)。
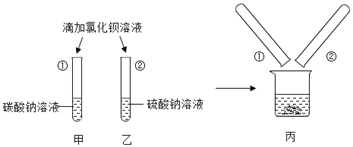
(1)甲组实验中观察到的现象是___。
(2)乙组实验中反应的化学方程式为___。
(3)实验结束后,甲、乙两组同学将全部的浊液集中倒进一个废液缸中(如图丙)。丙组同学对浊液进行过滤,探究滤液的成分。
(提出问题)滤液里除了NaCl外,还有什么物质?
(提出猜想)猜想Ⅰ:___;猜想Ⅱ:Na2SO4;猜想Ⅲ:Na2CO3;猜想Ⅳ:Na2CO3和Na2SO4
(实验探究)
探究方案 | 实验现象与结论 |
①若现象a只有白色沉淀,则猜想__成立。 ②若现象a只有__,则猜想Ⅲ和猜想Ⅳ可能成立。 | |
当现象b产生白色沉淀时,再向白色沉淀加入稀硝酸, ③若沉淀全部不溶解且无气泡产生,则猜想__成立; ④若沉淀全部溶解且__,则猜想Ⅲ成立; ⑤__且产生气泡,则猜想Ⅳ成立。 |
(拓展与思考)上述滤液的成分不可能出现的组合是BaCl2、Na2CO3和Na2SO4,原因是___。