题目内容
【题目】学完酸碱盐之后,小明头脑里一直有疑惑,为什么老师说金属活动顺序表中钾、钙、钠很活泼,却又不能把它后面金属从盐溶液中置换出来呢?带着疑问小明走进了实验室。
(查阅资料)钠是一种活泼金属,常温下能与氧气、水等物质发生反应。钠与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑。
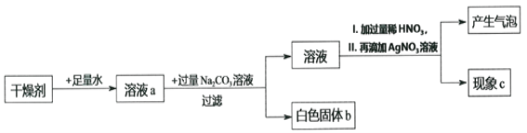
(实验探究)小明先取一定量的硫酸铜溶液于烧杯中,再取一小块钠投入硫酸铜溶液中,反应剧热,充分反应后过滤,得到滤液和蓝色滤渣,根据已学知识可推断蓝色滤渣为并对滤液的成分进行探究。
(猜想与假设)猜想一:Na2SO4;猜想二:Na2SO4和NaOH;猜想三_____。猜想四:Na2SO4、CuSO4和NaOH
小明认为猜想_____不合理,理由是_____(用化学方程式表示)。
(查阅资料)Na2SO4溶液呈中性
(实验与验证)
实验 | 实验操作 | 实验现象 | 实验结论 |
实验一 | 取少量滤液于试管中,仔细观察现象 | 溶液为无色 | 猜想_____不成立 |
实验二 | 向实验一所取滤液中滴入酚酞溶液 | _____ | 猜想一不成立 |
(拓展延伸)金属活动性顺序表中钠及前面的金属确实_____(填“能”或“不能”)把位于后面的金属从它们盐溶液里置换出来。
(继续探究)小明将4.6g钠投入到含HCl 3.65g的稀盐酸中,反应更加剧热,这是因为钠的性质很活泼,很容易失去最外层的一个电子而形成_____。请计算该过程中产生H2的质量_____。
【答案】Na2SO4和CuSO4 猜想四 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 三 溶液为红色 不能 Na+ 0.2g
【解析】
氢氧化钠、硫酸铜恰好完全反应生成氢氧化铜和硫酸钠,由于氢氧化钠和硫酸铜生成氢氧化铜蓝色沉淀,故不能共存。
[猜想与假设]
猜想一:氢氧化钠、硫酸铜反应生成氢氧化铜和硫酸钠,当恰好完全反应时,反应后溶液中的是Na2SO4;当硫酸铜过量时,反应后溶液中的溶质Na2SO4和CuSO4;当氢氧化钠过量时,反应后溶液中的溶质是Na2SO4和NaOH,故答案为:Na2SO4和CuSO4;
CuSO4和NaOH不能共存,反应生成氢氧化铜和硫酸钠,故猜想四不合理,反应的化学方程式为:![]() 。
。
[实验与验证]
实验一:CuSO4溶液呈蓝色,溶液为无色,所以猜想三不成立。
实验二:因为猜想一不成立,所以溶液呈碱性,向实验一所取滤液中滴入酚酞溶液,溶液呈红色。
[拓展延伸]根据题目中的信息可知,金属活动性顺序表中钠及前面的金属确实不能把位于后面的金属从它们盐溶液里置换出来。
[继续探究]钠原子核外最外层有一个电子容易失去形成带一个单位正电荷的阳离子,Na+;
钠无论与水还是盐酸反应,都是一个钠原子置换出一个氢原子
设4.6g钠完全反应生成氢气的质量为x
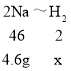
![]()
![]()
故生成的氢气的质量为0.2g。

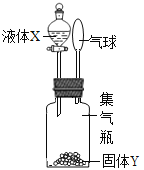
【题目】如图所示,将液体X加入到集气瓶中与固体Y作用,观察到气球逐渐变大,如表中液体X和固体Y的组合,符合题意的是( )
① | ② | ③ | ④ | ⑤ | |
X | 稀盐酸 | 水 | 水 | 双氧水 | 水 |
Y | 铁粉 | 氢氧化钠 | 氯化钠 | 二氧化锰 | 硝酸铵 |
A. ①②⑤ B. ①③④ C. ①②④ D. ②③⑤