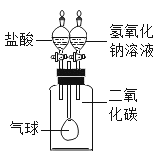
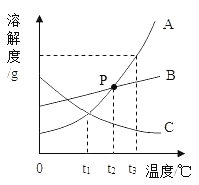
题目内容
【题目】某食品包装袋内的“脱氧剂”查阅资料发现其成分可能含有铁粉、碳粉、Na2CO3、NaCl、Fe2O3等,为确定其成分,进行了如下实验:
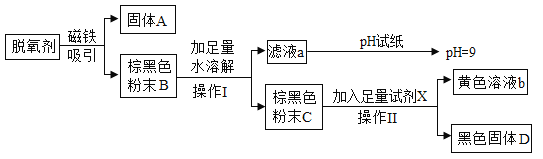
(1)固体A是_____________。
(2)操作I和操作Ⅱ为___________。
(3)加入的足量试剂X是_______。
(4)通过实验可知,脱氧剂中一定含有的物质是_________。
【答案】铁粉 过滤 稀盐酸(稀硫酸等合理即可) 铁粉、碳粉、Fe2O3、Na2CO3
【解析】
(1)磁铁能吸引铁,固体A能被磁铁吸引,故固体A是铁粉。
(2)过滤可将难溶于水的固体物质与液体分离,故操作I和操作Ⅱ为过滤。
(3)含有铁离子的溶液呈黄色,棕黑色粉末C中加入足量试剂X,得到黄色溶液b,因为铁粉、碳粉、Na2CO3、NaCl、Fe2O3中,只有Fe2O3能与酸反应生成黄色的铁盐溶液,所以加入的足量试剂X是稀盐酸或稀硫酸,同时证明一定含有Fe2O3。
(4)因为磁铁吸引得到固体A,固体A是铁粉,所以“脱氧剂”中含有铁粉;因为棕黑色粉末溶于水后,过滤得到的滤液pH=9,而铁粉、碳粉、Na2CO3、NaCl、Fe2O3中,只有碳酸钠溶于水其溶液pH>7,所以“脱氧剂”中含有碳酸钠;因为NaCl的水溶液pH=7,所以不能确定是否含有氯化钠;因为棕黑色粉末C中加入足量试剂稀盐酸或稀硫酸后,得到黄色溶液b和黑色固体D,氧化铁是一种红棕色的固体物质能和稀盐酸反应得到黄色溶液,碳粉是黑色固体且不和稀盐酸反应,所以脱氧剂中含有碳粉、Fe2O3。通过实验可知,脱氧剂中一定含有的物质是铁粉、碳粉、Fe2O3、Na2CO3。

 阅读快车系列答案
阅读快车系列答案【题目】为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物12.5g进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4═CuSO4+H2O+Cu。
(进行实验)
实验1:取一定量混合物,用如图所示装置进行多次试验,获得如下实验数据与现象。

序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2 | 1:10 | 混有很少量黑色物质 | |
3 | 1:11 | 混有极少量黑色物质 | |
4 | 1:12 | 无黑色物质 | |
5 | 1:13 | 混有较多黑色物质 |
(1)实验中,证明产生了CO2的现象是_____。
(2)该实验的结论是_____。
(反思与评价)
(3)实验2没有进行质量比为1:14的实验,理由是_____。
(4)为检验第4次实验的生成红色固体中是否含Cu2O,所需试剂是_____。
【题目】小李和小王同学对化学计算很有心得,以下是他们解答一道计算题的实录。请你一起参与研究并完成相关问题。( 计算结果精确到0.01g)
题目已知: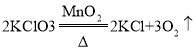 ,两位同学为了测定实验室中氯酸钾药品是否纯净,取2. 5g该药品与0. 5g二氧化锰混合。加热该混合物t3时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加t2 、t3、t4时间后剩余固体的质量,记录数据如下表:
,两位同学为了测定实验室中氯酸钾药品是否纯净,取2. 5g该药品与0. 5g二氧化锰混合。加热该混合物t3时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加t2 、t3、t4时间后剩余固体的质量,记录数据如下表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 2.12 | 2.08 | 2.04 | 2.04 |
(1)两同学一致认为氯酸钾已经完全反应的时间为_____(选填“t1”、 “t2”、“t3”、“t4”) 。
(2)小李根据质量守恒定律很快得到(2.5g+0.5g-2.04g)是_____(填化学式)的质量。
(3)请你计算:该药品中氯酸钾的质量,并判断该药品是否纯净?_____