题目内容
【题目】右图是甲、乙、丙三种物质的溶解度曲线.下列说法正确的是
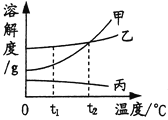
A. 在t1℃时,三种物质的溶解度由大到水的顺序是甲>乙>丙
B. 在t2℃时,甲、乙两物质的溶解度相等
C. 甲、乙、丙三种物质的饱和溶液升温都会转化为不饱和溶液
D. 当乙的饱和溶液中混有少量丙时,可采用降温结晶的方法析出丙
【答案】B
【解析】
根据溶解度曲线可知①在某温度下,某固体物质的溶解度,如:在t1℃时,三种物质的溶解度由大到小的顺序是乙>甲>丙;②在某温度下,不同物质的溶解度的大小,如:在t2℃时,甲、乙两物质的溶解度相等;③某物质的溶解度随温度的变化④判断某物质的饱和溶液和不饱和溶液间的转化方法,如:由于丙的溶解度随温度的升温而减小,因此给丙的饱和溶液升温后会有晶体析出;⑤可以确定混合物分离、提纯的方法,如:由于丙的溶解度随温度的降低而增大,因此降温不会使丙析出.
解答:解:有三种物质的溶解度曲线可知,在t1℃时,三种物质的溶解度由大到小的顺序是乙>甲>丙,故A错误;在t2℃时,甲乙两物质的溶解度曲线交于一点,说明在t2℃时,甲乙的溶解度相等,故B正确;由于丙的溶解度随温度的升高而减小,因此升温时,丙的饱和溶液中就会有晶体析出,故C错误;由于丙的溶解度随温度的降低而增大,温度越低,丙的溶解度会越大,因此降温不会使丙析出,故D错误.故选B

【题目】化学兴趣课上,同学们对过氧化钠(Na2O2)可以做供氧剂产生了浓厚兴趣,于是在老师的指导下展开了以下探究活动。
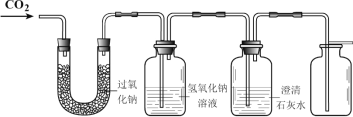
(提供资料)① 二氧化碳与过氧化钠反应生成氧气和另一种物质。② 碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)与盐酸反应均能生成CO2。③ 2Na2O2 + 2H2O === 4NaOH + O2↑。
(1)证明二氧化碳与过氧化钠反应产生氧气并收集一瓶氧气。
同学们在老师的指导下设计了如上图所示装置。
① 如何证明氧气已经收集满______。
② 氢氧化钠溶液的作用是除去未反应的二氧化碳,若观察到______,说明二氧化碳已经除尽。
(2)探究二氧化碳与过氧化钠反应生成的另一种物质。
(猜想与假设)下面是同学们提出的3种猜想。
猜想1:是氢氧化钠 猜想2:是碳酸氢钠 猜想3:是碳酸钠
通过对反应物中有关元素的组成分析,你认为猜想______是不正确的,理由是______。
(进行实验)同学们通过以下实验验证了另一种物质,请完成下述实验报告。
实验操作 | 实验现象 | 实验结论 |
取少量CO2与Na2O2反应后的固体于试管中,______。 | 有大量气泡产生,澄清石灰水变浑浊。 | 猜想______是正确的。 |
澄清石灰水变浑浊的化学方程式为______
(反思与评价)若用人呼出的气体通过上图装置,证明二氧化碳与过氧化钠反应生成了氧气,你是否同意这种做法,并阐述理由_______________。
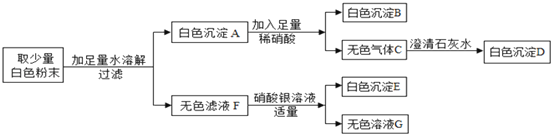
【题目】有一包白色粉末,可能由CuSO4、Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种组成。为探究其组成,同学们查阅资料得知NaCl、BaCl2溶液呈中性,经过思考设计并进行了以下实验:
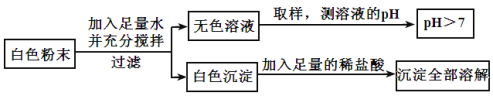
(1)白色粉末中一定不含_____________;可能含有____________。
(2)为最终确定白色粉末的组成,还需要对无色滤液中呈碱性的物质进行探究。
(提出问题)无色滤液中呈碱性的物质是什么?
(作出猜想)猜想Ⅰ:Na2CO3
猜想Ⅱ:NaOH
猜想Ⅲ:Na2CO3和NaOH
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
① 取无色滤液少许于试管中,滴加过量的BaCl2溶液 | ________ | 猜想Ⅱ不成立 |
② 在①反应后的试管中滴加________ | 溶液变为红色 | 猜想Ⅲ成立 |
(得出结论)白色粉末的成分是________________。