题目内容
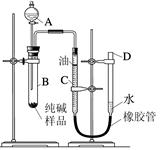
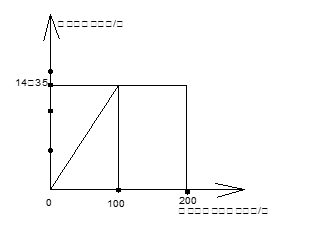
(6分)小强在公共场所围墙上看到一则化肥广告(如图),他通过计算判断出该广告是虚假广告,并向有关部门反映。

(1)请计算硝酸铵中各元素的质量比。(请写出详细的计算过程)
(2)已知该产品中的杂质不含氮元素,请你尝试写出小强的计算过程和判断依据。(请写出详细的计算过程)
(3)技术监督局对该产品进行取样分析,发现氮元素的质量分数仅为28%。请计算该产品中硝酸铵的质量分数。(请写出详细的计算过程)

(1)请计算硝酸铵中各元素的质量比。(请写出详细的计算过程)
(2)已知该产品中的杂质不含氮元素,请你尝试写出小强的计算过程和判断依据。(请写出详细的计算过程)
(3)技术监督局对该产品进行取样分析,发现氮元素的质量分数仅为28%。请计算该产品中硝酸铵的质量分数。(请写出详细的计算过程)
(1)NH4NO3中氮元素、氢元素和氧元素的质量比=(14×2)︰(1×4)︰(16×3)= 7︰1︰12 (过程1分,答案1分,答案未化简扣0.5分)
(2)NH4NO3的相对分子质量 =" 14×2+1×4+16×3" = 80
NH4NO3中氮元素的质量分数 =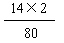 ×100% =" 35%" (1分)
×100% =" 35%" (1分)
因为纯硝酸铵中氮元素的质量分数尚且小于 38%,所以该广告是虚假广告(1分)
(3)设该产品为100g,其中氮元素的质量 =" 100g×28%" = 28g
NH4NO3的质量 =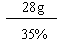 =" 80g"
=" 80g"
产品中NH4NO3的质量分数 =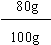 ×100% = 80% (过程1分,答案1分)
×100% = 80% (过程1分,答案1分)
(2)NH4NO3的相对分子质量 =" 14×2+1×4+16×3" = 80
NH4NO3中氮元素的质量分数 =
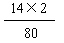 ×100% =" 35%" (1分)
×100% =" 35%" (1分)因为纯硝酸铵中氮元素的质量分数尚且小于 38%,所以该广告是虚假广告(1分)
(3)设该产品为100g,其中氮元素的质量 =" 100g×28%" = 28g
NH4NO3的质量 =
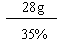 =" 80g"
=" 80g" 产品中NH4NO3的质量分数 =
 ×100% = 80% (过程1分,答案1分)
×100% = 80% (过程1分,答案1分)(1)根据广告图可知物质的化学式,利用相对原子质量来计算元素的质量比;
(2)计算氮元素的质量分数,根据氮元素的质量分数来判断广告的真实性;
(3)根据该产品中氮元素的质量为硝酸铵中的氮元素的质量来计算该产品中硝酸铵的质量分数
(2)计算氮元素的质量分数,根据氮元素的质量分数来判断广告的真实性;
(3)根据该产品中氮元素的质量为硝酸铵中的氮元素的质量来计算该产品中硝酸铵的质量分数

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目