题目内容
【题目】水与人类的生活和生产密切相关。
(1)我国药学家屠呦呦因研制新型抗疟药青蒿素和双氢青蒿素而获得了诺贝尔奖。东晋名 医葛洪《肘后备急方》中就有青蒿素抗疟的记载:“青蒿一握,以水二升渍,绞取汁,尽服之”。这里的“水”作_____。上述水煎青蒿治疗疟疾,药性很不稳定,效果很差,屠呦呦改用乙醇提取,控温 60℃,药性显著提高,说明青蒿素具有的性质是(答一条):_____ 。
(2)利用下图甲所示装置净化河水,下列说法错误的是_____
A.活性炭层可除去异味和色素 B.此净化水的过程主要发生的是物理变化
C.此装置可以将硬水软化 D.利用此装置净化得到的水不宜直接饮用

(3)电解一定量的水(如上图乙),当负极端产生 10mL 气体时, 理论上在正极端产生气体的体积为_____mL。
(4)能说明水是由氢元素和氧元素组成的实验是_____(填序号)
A.氢气在氧气中的燃烧 B.氢气在氯气中的燃烧
C.水的净化 D.水的电解
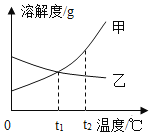
(5)下图是 a、b、c 三种固体物质的溶解度曲线

①t2℃时,将等质量的 a、b 两种物质加水溶解配制成饱和溶液,所 得溶液质量的大小关系为:a_____b(填“>”、“<”或“=”)。
②t1℃时,将 60g 物质 a 的饱和溶液升温至 t2℃(溶剂量不变),至 少需要加入______g 物质 a 才能重新达到饱和状态。
③将 t2℃时 a、b、c 三种物质的饱和溶液降温至 t1℃,溶液中溶质 质量分数的大小关系是_____。
(6)若要配制 245g 溶质质量分数为 10%的稀硫酸,需要溶质质量 分数为 98%的浓硫酸(密度为 1.84g/cm3)_____mL(计算结果
保留一位小数)。实验室用浓硫酸配制稀硫酸的主要步骤有:计算、_____、混匀、 冷却至室温装瓶并贴上标签。
【答案】 溶剂 易溶于乙醇或温度升高,青蒿素的溶解度增大 C 5 AD < 15 b>a>c 13.6 量取
【解析】(1)根据题中信息分析解答;(2) A、根据活性炭具有吸附性解答;B、根据净水过程中有无新物质生成解答;C、根据硬水转化为软水的方法分析解答;D、根据此装置净水过程中还含有可溶性杂质、细菌、病毒等解答;(3)根据电解水实验结论解答;(4)根据质量守恒定律解答;(5)根据溶解度曲线分析解答;(6)根据配制一定溶质质量分数的溶液计算解答。(1) 以水二升渍,水作的是溶剂;屠呦呦改用乙醇提取,控温60℃,药效显著提高,是因为易溶于乙醇且温度升高,青蒿素的溶解度增大;(2) A、活性炭具有吸附性,可除去异味和色素,正确;B、此净化水的过程中没有新物质生成,主要发生的是物理变化,正确;C、硬水软化的方法生活中是煮沸,实验室是蒸馏。利用该装置不可以将硬水软化,错误;D、此装置净水过程中还含有可溶性杂质、细菌、病毒等,所以还不能直接饮用,正确。故选C;(3)水通电分解,正极生成氧气,负极生成氢气,二者的体积比为1:2。当负极端产生 10mL 气体时, 理论上在正极端产生气体的体积为5mL;(4) 氢气在氧气中燃烧生成了水,氢气是由氢元素组成的,氧气是由氧元素组成的,根据质量守恒定律化学反应前后元素的种类不变可知水是由氢元素和氧元素组成的;电解水实验中生成了氢气和氧气,氢气是由氢元素组成的,氧气是由氧元素组成的,根据质量守恒定律化学反应前后元素的种类不变可知水是由氢元素和氧元素组成的,故选AD;(5)①t2℃时 a 物质的溶解度大于 b 物质的溶解度,因此在该温度下等质量的 a 和b 物质加水配成饱和溶液时,溶解 a 需要的水质量小于溶解 b 需要的水的质量,因此 a 饱 和溶液的质量小于 b 饱和溶液的质量;②t1℃时 60ga 的饱和溶液中溶质质量是 10g,溶剂质量是 50g,在升温到 t2℃时,溶解度变 为 50g,所以此时 50g 水中溶解 a 达到饱和时 a 的质量是 25g,因此需要加入 a 的质量是15g;③t2℃时三种物质的饱和溶液降温到 t1℃时,a 和 b 仍然饱和,t1℃时 b 的饱和溶液溶质质量分数大于 a 的饱和溶液溶质质量分数,c 的溶液溶质质量分数和 t2℃时相等,小于 a 的饱和溶液在 t1℃时的溶质质量分数,因此 t1℃时溶液溶质质量分数排序 b>a>c;(6)设需要98%的浓硫酸的体积为x。245g×10%=98%×1.84 g/cm3×x,x=13.6g;实验室用浓硫酸配制稀硫酸的主要步骤有:计算、量取、混匀、 冷却至室温装瓶并贴上标签。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案