题目内容
【题目】结合下图回答问题:
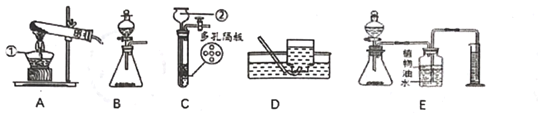
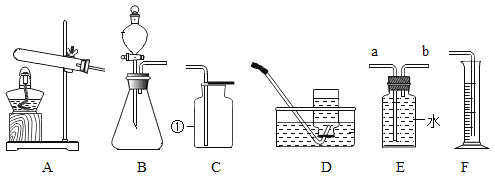
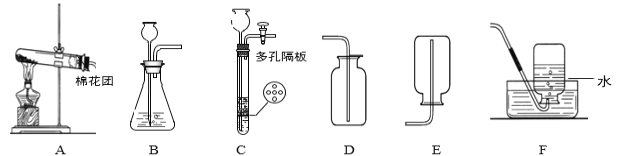
(1)写出编号仪器的名称:①___②___
(2)用高锰酸钾制取氧气,可选用的发生装置是____(填序号), 该反应的化学方程式为____。用D装置收集氧气完毕后,应先____选填 “从水中取出导管"或“熄灭酒精灯”)。
(3)实验室可用装置B或C制CO2该反应的化学方程式为____,B装置相对于C装置的优点有___。
(4)若用上述制取CO2的装置来制取O2发生反应的化学方程式为____:其基本反应类型为___反应。
(5)F图装置可用于制取二氧化碳并测量二氧化碳的体积。实验中,二氧化碳的体积可以通过___(填仪器名称)中液体的体积来表示。装置中植物油的作用是___。集气瓶中未装满水,液面上的空气对实验结果___(选填“有" ”或“无" )影响。不考虑气压和温度的影响,用此套装置的测量结果仍然偏大,其原因是__。
【答案】酒精灯 长颈漏斗 A 2KMnO4![]() K2MnO4 +MnO2+O2↑ 从水中取出导管 CaCO3+2HCl=CaCl2+H2O+CO2↑ 通过控制液体药品用量来控制反应速率 2H2O2
K2MnO4 +MnO2+O2↑ 从水中取出导管 CaCO3+2HCl=CaCl2+H2O+CO2↑ 通过控制液体药品用量来控制反应速率 2H2O2![]() 2H2O+O2↑ 分解 量筒 防止二氧化碳溶于水或与水反应 无 加入的稀盐酸的体积也计算在气体的体积内(合理答案均可给分)
2H2O+O2↑ 分解 量筒 防止二氧化碳溶于水或与水反应 无 加入的稀盐酸的体积也计算在气体的体积内(合理答案均可给分)
【解析】
(1)仪器1是酒精灯,仪器2是长颈漏斗。
(2)高锰酸钾制取氧气的装置是固固加热型装置,故选A。高锰酸钾在加热的条件下反应生成锰酸钾、二氧化锰和氧气,反应的方程式为:2KMnO4![]() K2MnO4 +MnO2+O2↑。用排水法收集氧气结束时,要向将导管从水中移出,后熄灭酒精灯,防止水倒流引起试管炸裂。
K2MnO4 +MnO2+O2↑。用排水法收集氧气结束时,要向将导管从水中移出,后熄灭酒精灯,防止水倒流引起试管炸裂。
(3)实验室制取二氧化碳是用碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,反应的方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑。B装置是将固体碳酸钙放在隔板的上面,可以起到随时控制反应的发生与停止,而C装置的优点是可以控制加入稀盐酸的量的多少,从而控制反应的速率。
(4)用B或C装置制取氧气属于固液常温型装置,故是用过氧化氢制取氧气,过氧化氢在二氧化锰做催化剂的条件下反应生成水和氧气,反应的方程式为:2H2O2![]() 2H2O+O2↑。该反应的特点是一变多的反应,故是分解反应。
2H2O+O2↑。该反应的特点是一变多的反应,故是分解反应。
(5)该装置中进入多功能瓶中多少体积的二氧化碳,就有多少体积的水被挤入量筒中,故可以通过读取量筒中水的体积得知二氧化碳的体积。该收集方法中为了防止生成的二氧化碳溶解与水中,故水面上放由少量的油。该装置中进入多功能瓶中多少体积的二氧化碳,就有多少体积的水被挤入量筒中,故瓶中的空气对测定结果不影响。该测定方法中,加入的稀盐酸的体积也计算在气体的体积内,故测量的结果偏大。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氯化钠与硝酸钠的溶解度曲线如图:
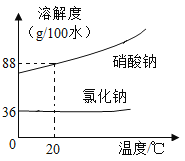
(1)20℃时溶解度较小的物质是______。
(2)从硝酸钠和氯化钠的混合溶液中提纯硝酸钠的方法是_____,可以利用该方法提纯硝酸钠的理由是_____。
Ⅰ.固体混合物中硝酸钠的含量较高,氯化钠的含量较低
Ⅱ.硝酸钠的溶解度受温度影响变化较大
Ⅲ.0℃至100℃,硝酸钠的溶解度始终大于氯化钠
(3)海水中有氯化钠,我们可以利用海水晒盐。某地海水中主要物质的含量见表。
物质 | 每100g海水所含质量(g) |
水 | 96.5 |
氯化钠 | 2.7 |
硫酸钠 | 0.2 |
…… |
①该海水中氯化钠的质量分数为_____。
②20℃时的100g该海水,当水的蒸发量大于____g时,开始析出氯化钠。
【题目】将丙醇(![]() )和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表。下列判断正确的是( )
)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表。下列判断正确的是( )
物质 |
|
|
|
| X |
反应前质量/g | 6.0 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 8.8 | A |
A.X是该反应的催化剂B.X是该反应的反应物
C.X可能含有氧元素D.X不可能含有氢元素