题目内容
【题目】取一定量经粉碎的铜锌合金,先加足量稀硫酸,完全反应(酸溶)后过滤,再将洗净后滤渣在O2中充分灼烧。固体质量(g)与各实验时间关系如图示。下列说法正确的是
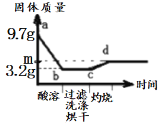
A. 合金中Zn的质量为3.2g
B. a-b段反应得蓝色溶液
C. 合金中铜、锌质量比为32:65
D. c-d段固体为CuO,m点对应的质量为4g
【答案】CD
【解析】
A、分析题意结合图示可知,合金中Zn的质量=9.7g-3.2g=6.5g,Cu的质量=9.7g-6.5g=3.2g,故选项错误;
B、a-b段是锌和硫酸反应生成无色硫酸锌溶液和氢气,故选项错误;
C、分析题意结合图示可知,合金中Zn的质量=9.7g-3.2g=6.5g,Cu的质量=9.7g-6.5g=3.2g,合金中铜、锌质量比=3.2g:6.5g =32:65,故选项正确;
D、c-d段的反应是2Cu+O2![]() 2CuO,根据质量守恒定律3.2g铜生成氧化铜的质量为4g,故选项正确。
2CuO,根据质量守恒定律3.2g铜生成氧化铜的质量为4g,故选项正确。
故选CD。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】下面是一些关于铁的实验研究,试按要求填空。
一、图1为实验室模拟炼铁的实验改进装置(部分夹持仪器略去)。实验步骤如下:

Ⅰ.连接好装置,并检查装置气密性;
Ⅱ.装好药品,先通一会CO,再点燃酒精灯;
Ⅲ.实验结束,先撤去酒精喷灯,继续通CO直至玻璃管冷却;
回答下列问题:
(1)实验中可看到A处的现象为_________,该反应的化学方程式为________。
(2)步骤Ⅱ中先通一会CO,再点燃酒精喷灯的目的是__________。
(3)盛满石灰水的B装置在此实验中的作用有如下说法:
①收集多余的一氧化碳 ②检验并吸收反应生成的二氧化碳,上述说法中正确的是______。
A. 只有① B. 只有② C. 是①和②
(4)为进一步证明玻璃管中固体有铁生成,按要求设计实验方案。
验证方法 | 实验操作 | 实验现象、结论 |
物理方法 | __________ | __________ |
化学方法 | __________ | __________ |
(5)冶炼480万吨含氧化铁60%的赤铁矿石,理论上能得到含杂质4%的生铁的质量是________。
二、铁锈的探究
用图2所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁钉):
①甲同学认为,试管A发生的现象就能够说明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果。乙同学不同意他的观点,认为必须全面观察试管__________(选填试管编号)发生的现象,并经过科学严谨的推理,才能得出上述结论。
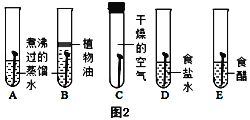
②试管D和E实验的目的是进一步探究铁在_________的环境中是否更容易锈蚀。
③A、B试管中用煮沸过迅速冷却的水,煮沸的目的是_________。
【题目】工业上生产电石(CaC2)并制备重要工业原料乙炔(CxHy)流程如图1:
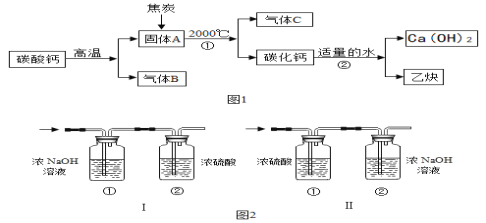
(资料)
(1)CaCO3![]() CaO(固体)+CO2↑。
CaO(固体)+CO2↑。
(2)浓硫酸是常用的干燥剂,NaOH 溶液能吸收CO2。
(讨论)
(1)C、B组成元素相同,C有毒,反应①的化学方程式为_______。
(测定乙炔组成)资料:一个乙炔分子由四个原子构成。
(2)将一定量的乙炔(CxHy)完全燃烧,并将生成的气体缓缓通过图2的_________
(选填“I”或“II”)装置,并再缓缓通入一段时间 的 N2,并记录实验数据于表中。
反应前质量/g | 反应后质量/g | |
装置① | 125.3 | 127.1 |
装置② | 78.2 | 87.0 |
(3)实验中“缓缓通入一段时间 N2”的目的是___________。
(4)计算:乙炔中碳元素的质量为________g,氢元素 的质量为_______g,乙炔的化学式为_________。
(5)反应②的化学方程式___________。