题目内容
【题目】下图是配制50g质量分数为5%的氯化钠溶液的操作过程示意图,试回答:
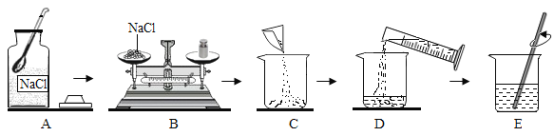
(1)E 中玻璃棒的作用____;
(2)D 操作应选用________mL 的量筒(从 50 mL、100 mL 中选择);
(3)配制过程中,图中还缺少的玻璃仪器是____;
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是_______(填序号)。
A 氯化钠固体不纯
B 用生锈砝码称量
C 量取水时仰视读数
D 溶解时烧杯内壁有水珠
【答案】搅拌,加速溶解 50 胶头滴管 ACD
【解析】
(1)E是溶解操作,玻璃棒的作用是搅拌,加速溶解。
(2)配制50g质量分数为5%的氯化钠溶液,氯化钠的质量为![]() ,水的质量为
,水的质量为![]() ,水的体积为
,水的体积为![]() ,故D操作应选用50mL的量筒。
,故D操作应选用50mL的量筒。
(3)溶质的称量需要托盘天平,量取溶剂需要量筒、胶头滴管,溶解需要烧杯和玻璃棒,故配制过程中,图中还缺少的玻璃仪器是胶头滴管。
(4) A、氯化钠固体不纯,使氯化钠的质量偏小,配制溶液溶质的质量分数偏小,故A正确;
B、砝码生锈,导致称量的氯化钠质量偏大,配制溶液溶质的质量分数偏大,故B不正确;
C、量取水时仰视读数,读数偏小,实际量取的液体偏大,溶液质量偏大,配制溶液溶质的质量分数偏小,故C正确;
D、溶解时烧杯内壁有水珠,使水的质量偏大,配制溶液溶质的质量分数偏小,故D正确。故选ACD。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)
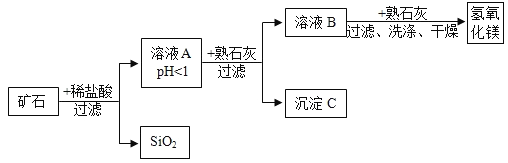
请回答下列问题:
(1)写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式______(只写一个)。
(2)在过滤操作中,玻璃棒的作用是______。
(3)在溶液A中加入熟石灰调节溶液的pH可以使溶液中的金属阳离子逐步转化为沉淀。在该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,所得溶液B的pH的取值范围为______
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 8.6 |
完全沉淀的pH | 3.2 | 6.7 | 11.1 |
(4)写出在溶液B中加入熟石灰发生的化学反应方程式:______。
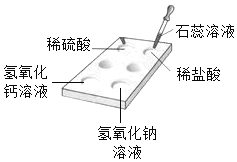
【题目】分类法在日常生活和科学研究中具有广泛的应用。化学实验可以按照实验目的分为:“探究物质性质实验、探究物质含量实验、探究反应条件实验”等。请回答问题:
(1)我们可以将实验D与实验_____(填字母)分为一类,分类依据是________。
A | B | C | D |
|
|
|
|
(2)某同学做中和反应实验时,用pH传感器测得溶液的pH变化如图所示。
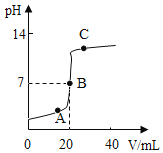
①向A点溶液中滴加紫色石蕊溶液,实验现象是______
②C点溶液中有_____种溶质。
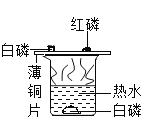
【题目】理科实验操作考试中有关于探究金属的某些物理性质和化学性质的试题,用坩埚钳夹取打磨过的铜片在酒精灯上加热,发现铜片表面变黑,为了探究黑色物质的成分。
(查阅资料)(1)铜的氧化物主要有两种:CuO(黑色);Cu2O(红色)
(2)酒精在不完全燃烧时会产生炭黑
(3)炭黑不与稀硫酸反应,也不溶于稀硫酸;氧化铜可与稀硫酸反应而溶解
(提出假设)猜想1:黑色物质为_____________。
猜想2:黑色物质为炭黑。
猜想3:黑色物质为_____________。
(设计方案)
操作步骤 | 实验中可能出现的现象 | 实验结论 |
取少量黑色固体于试管中,加入 足量___________(填物质名称) | ①_______ | 猜想1成立 |
② 黑色固体没有减少,溶液颜色不变 | 猜想2成立 | |
③_______ | 猜想3成立 |
(得出结论)通过实验现象,得出猜想3成立,此黑色固体为混合物。请写出实验中发生的化学方程式____________。