题目内容
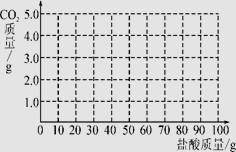
【题目】取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。求:

(1)混合物CaCO3中的质量为 ;
(2)稀盐酸中的溶质质量分数为 ;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数?(写出计算过程,计算结果精确到0.1%)
【答案】
(1)10g (2)7.3% (3)12.6%
【解析】
试题分析:盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,由图可知:二氧化碳的质量为4.4g
设碳酸钙的质量为x,稀盐酸中的溶质质量为z,生成氯化钙的质量为y。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
x z y 4.4g
![]()
x=10g z=7.3g y=11.1g
(1)混合物CaCO3中的质量为10g;
(2)稀盐酸中的溶质质量分数为![]() 100%=7.3%;
100%=7.3%;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数=![]() 100%≈12.6%。
100%≈12.6%。

【题目】现有10%的Na2CO3溶液,请按下面要求计算:
(1)106 g上述溶液中所含溶质的质量 g。
(2)106 g上述溶液与足量10%的盐酸反应,最多可生成CO2多少克?
(3)向106 g上述溶液中逐滴加入10%的盐酸并不断搅拌,此时发生的反应为Na2CO3+HCl===NaHCO3+NaCl;当Na2CO3全部转化为NaHCO3后,再加入盐酸才开始放出CO2。请在图中画出产生气体的曲线。
(4)另取10%的Na2CO3溶液边搅拌边加入10%的盐酸,有关反应物与生成物的量如下表:
物质 | Na2CO3 | HCl | X | NaCl | CO2 | H2O |
质量/g | 31.8 | 14.6 | 16.8 | 23.4 | 4.4 | w |
则w= ,
写出该反应的化学方程式 。
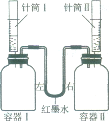
【题目】如下图所示进行实验,容器I、II体积相同,装置气密性良好,实验开始前红墨水左右两端液面相平。实验时同时将针筒内溶质质量分数相同且足量的稀硫酸全部迅速注入容器中,实验操作如下表:
实验编号 | 容器Ⅰ | 针筒Ⅰ | 容器Ⅱ | 针筒Ⅱ |
甲 | 0.01mol镁 | 15mL稀硫酸 | 0.01mol 锌 | 15mL稀硫酸 |
乙 | 0.01mol锌 | 15mL稀硫酸 | 0.01mol铝 | 15mL稀硫酸 |
丙 | 0.01mol铜 | 15mL稀硫酸 | 0.01molg锌 | 15mL稀硫酸 |
实验结束红墨水左右两端液面呈现左高右低。能符合该实验现象的实验编号为
A. 甲、乙 B. 甲、丙
C. 乙、丙 D. 甲、乙、丙