题目内容
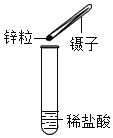
【题目】运用手持技术探究金属与酸的反应。向 250mL 的烧瓶内注入 25mL 溶质质量分数 8.8%的稀盐酸,分别剪取长约 0.4cm、宽约 0.4cm 的镁、铝、 锌、铁、铜金属条,打磨后投入烧瓶中,迅速塞紧带有压强传感器的橡皮塞(见图 ),点击采集 得到如图 所示的气压变化曲线。 回答下列问题:
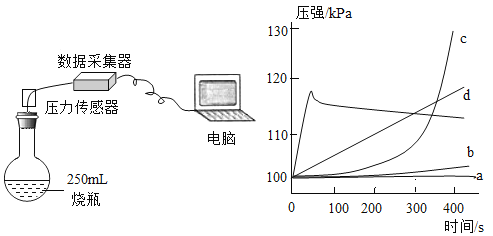
(1)曲线 a 对应的金属是 ___。
(2)曲线 b 对应的金属是铁,反应的化学方程式为 ___。
(3)曲线 c 在 18s 左右达到最高点后又略微下降的原因是 ___。
(4)下列说法错误的是(________)
A d 对应的反应速率适中,适合实验室制取气体
B 如延长反应时间,可得到 d 的图像是一条直线
C 从 0~100s 图像可推测 e 对应的金属打磨不彻底
D 从 250~450s 图像推测 e 反应时盐酸浓度在变大
【答案】Cu ![]() 镁与稀盐酸的反应放热,在18s左右反应结束,温度下降 BD
镁与稀盐酸的反应放热,在18s左右反应结束,温度下降 BD
【解析】
(1)常见金属活动顺序里,铜排在氢后面,铜不能置换出盐酸中的氢,故曲线a对应的金属为Cu(铜);
(2)铁与稀盐酸反应的化学方程式为![]() ;
;
(3)镁在稀盐酸会剧烈反应,释放出大量的热,使得分子运动剧烈,分子间隙变大,从而使压强变大,18S时反应正好完成,温度下降,所以压强变小,曲线下降;
(4)A、d的曲线没有陡升陡降,表示随着实验进行产生气体慢慢增加,金属与盐酸的反应没有那么剧烈,适合实验室制取氢气,故A正确;
B、延长反应时间后,随着金属完全与盐酸反应后,不再放热和产生气体,压强会慢慢下降,d曲线会变成一条折线而不是直线;
C、曲线e对应的金属为铝,铝容易与空气中的氧气发生反应在表面形成一层致密的氧化铝薄膜,因未打磨彻底,在1-100S时,氧化铝与盐酸反应,直到铝表面的氧化铝薄膜与盐酸完全反应后铝才开始与盐酸反应,释放热量生成氢气,故C正确;
D、在250-450S压强陡增,说明铝与盐酸发展剧烈反应,根据质量守恒定律,生成物质量增加,盐酸质量减少,浓度变小,故D错误。故选BD。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
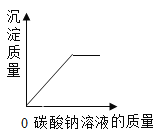
黄冈小状元口算速算练习册系列答案【题目】小明同学为了测定用于实验室制取二氧化碳的原料石灰石(主要成分是碳酸钙)中碳酸钙的质量分数,称取11.1 g研碎的石灰石粉末样品进行四次高温加热、冷却、称量,记录数据如下(杂质不反应):
操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体/g | 8.5 | 7.9 | 6.7 | 6.7 |
已知碳酸钙高温下分解生成氧化钙和二氧化碳,问:
(1)到第________次反应时,碳酸钙完全反应。
(2)样品完全反应时生成二氧化碳_____ g。
(3)样品中碳酸钙的质量分数是多少?(计算结果精确到0.1%)
【题目】为防控新型冠状病毒感染的肺炎疫情,小明家购入了3%过氧化氢消毒液和84消毒液[主要成分(NaClO)],小明将两种消毒液混合后,观察到产生大量气泡,为此小明进行了初步探究。
[资料]NaClO遇水和二氧化碳,反应生成碳酸氢钠和HClO,HClO有刺激性气味,是一种酸,酸性很弱,易分解生成盐酸和氧气。
探究一、探究两种消毒液混合产生的气体成分。
[设计与实验]
操作 | 现象 | 结论 |
取“84”消毒液稀溶液于试管中,滴加3%的过氧化氢溶液,___ | 产生大量无色气体,__ | 产生的气体是氧气 |
探究二、两种消毒液混合时,NaClO是反应物还是催化剂?
[实验设计]如下图所示实验装置,将注射器中30mL3%的过氧化氢溶液平均分6次注入锥形瓶中。
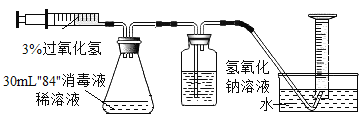
(1)检查装置气密性的方法:将导管的一端放入水中,将注射器的栓塞缓慢向外拉动至某一刻度,观察到水进入导管,则装置气密性良好。
(2)再次注入过氧化氢溶液后,待不再产生气泡,记录收集的气体体积(如下表)。(忽略其他有关因素对测量结果造成的影响)
[数据记录]
实验编号 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 |
量筒内气体总体积/mL | 103 | 206 | 257 | 262 | 267 | X |
[数据分析]表中的数据X=______。
[实验结论]通过分析表中的数据,根据_____,可推知NaClO是反应物。经进一步证明,NaClO与过氧化氢反应后的溶液为氯化钠溶液,请写出NaClO与过氧化氢反应的化学方程式:_______。
[拓展]生活中常用到洗涤剂、消毒剂、染发剂、防腐剂等化学品,使用前需仔细阅读说明书,不能轻易将它们混合使用,否则会因发生反应影响使用效果甚至产生有毒物质,影响健康。