题目内容
【题目】水是我们熟悉的物质。
①为了测定水的组成,进行如下探究:
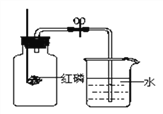
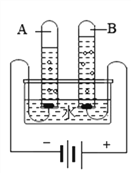
甲方案:电解水时玻璃管内的现象是____________;b管内生成的气体是______________;检验a管内产生气体的方法是___________。生成气体的体积比是___________,该实验说明水是由氢、氧元素组成的理论依据是__________;
电解水时,常加入少量氢氧化钠使电解水反应容易进行,而氢氧化钠本身的质量和化学性质不发生变化。若水电解装置中盛有一定量的氢氧化钠溶液,通电一段时间后,产生了16g氧气,管内溶液中氢氧化钠的质量分数由 2.7%变为3.0%。试计算
Ⅰ.参加反应的水的物质的量____________mol(根据化学方程式列式计算)。
Ⅱ.电解前氢氧化钠溶液的质量为________________g。
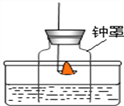
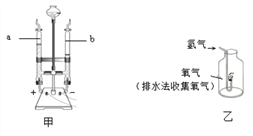
乙方案:该方案的实验目的是____________________,氢气在氧气中燃烧,反应的化学方程式是_________________,现象__________;该实验能否达到实验目的,并阐述理由___________。
②下表是KNO3 、NaCl在不同温度下的部分溶解度数据。
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32.0 | 45.8 | 64.0 | 85.5 | 110.0 | 138.0 | 169.0 | 202.0 | 246.0 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
Ⅰ. 以上两种物质溶解度的变化受温度影响较小的是___________。
Ⅱ. 在40℃时,将40gKNO3溶解在50g水中,形成溶液的质量是_______g。若升温至60℃,形成的溶液为________(填“饱和”或“不饱和”)溶液,该溶液的溶质质量分数为_______。
Ⅲ.根据表中数据,找出60.0g水能够溶解66.0g KNO3的温度范围是___________。
Ⅳ. 固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为________。
Ⅴ.气体在水中的溶解度也有一定的变化规律。下图为不同温度下,某气体的溶解度与温度的关系。
图中P1与P2表示气压,则P1与P2的关系是________。
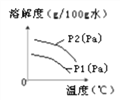
A.P1>P2
B.P1=P2
C.P1<P2
D.无法确定
【答案】 有大量气泡,液面下降 氢气或H2 将带火星的木条伸到尖嘴导管处,余烬木条复燃 V(H2):V (O2)=2:1 (合理得分) 质量守恒定律 1 mol 180g 用化合的方法测定水的组成 2H2+O2![]() 2H2O 【答题空10】剧烈燃烧,产生蓝色(淡蓝色)火焰,集气瓶内壁有水珠 不能,因为用排水法收集氧气,会带有大量水分。(前后对应正确,给分) 氯化钠或NaCl 82 不饱和 4/9或44.4% t≥60℃ 溶解、蒸发浓缩、冷却热饱和溶液、过滤(洗涤)、烘干 C
2H2O 【答题空10】剧烈燃烧,产生蓝色(淡蓝色)火焰,集气瓶内壁有水珠 不能,因为用排水法收集氧气,会带有大量水分。(前后对应正确,给分) 氯化钠或NaCl 82 不饱和 4/9或44.4% t≥60℃ 溶解、蒸发浓缩、冷却热饱和溶液、过滤(洗涤)、烘干 C
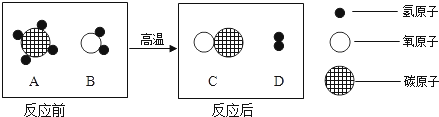
【解析】①甲方案:电解水生成氢气和氧气,玻璃管内的现象是有大量气泡,液面下降;b管内产生的气体较多是氢气,a管内产生的气体较少时氧气;检验a管内产生气体的方法是将带火星的木条伸到尖嘴导管处,余烬木条复燃。生成气体的体积比是V(H2):V (O2)=2:1,根据质量守恒定律可以得出水是由氢、氧元素组成的结论;Ⅰ、16g氧气的物质的量为![]() ,设参加反应的水的物质的量为
,设参加反应的水的物质的量为![]() mol,
mol,
2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
2 1
![]() 0.5mol
0.5mol
![]() ,解得
,解得![]() =1mol;Ⅱ、设电解前氢氧化钠溶液的质量为yg,根据反应前后溶质的质量不变得
=1mol;Ⅱ、设电解前氢氧化钠溶液的质量为yg,根据反应前后溶质的质量不变得![]() ,解得y=180g;乙方案:该方案的实验目的是用化合的方法测定水的组成,氢气在氧气中剧烈燃烧,产生蓝色(淡蓝色)火焰,集气瓶内壁有水珠,反应的化学方程式是:2H2+O2
,解得y=180g;乙方案:该方案的实验目的是用化合的方法测定水的组成,氢气在氧气中剧烈燃烧,产生蓝色(淡蓝色)火焰,集气瓶内壁有水珠,反应的化学方程式是:2H2+O2![]() 2H2O;该实验不能达到实验目的,因为用排水法收集氧气,会带有大量水分;②Ⅰ、从表中数据可知,以上两种物质溶解度的变化受温度影响较小的是氯化钠;Ⅱ、40℃时,KNO3溶解度为64.0g,故在40℃时,将40gKNO3溶解在50g水中,形成溶液的质量是32g+50g=82g,60℃时,KNO3溶解度为110.0g,升温至60℃,形成的溶液为不饱和溶液,该溶液的溶质质量分数为
2H2O;该实验不能达到实验目的,因为用排水法收集氧气,会带有大量水分;②Ⅰ、从表中数据可知,以上两种物质溶解度的变化受温度影响较小的是氯化钠;Ⅱ、40℃时,KNO3溶解度为64.0g,故在40℃时,将40gKNO3溶解在50g水中,形成溶液的质量是32g+50g=82g,60℃时,KNO3溶解度为110.0g,升温至60℃,形成的溶液为不饱和溶液,该溶液的溶质质量分数为![]() ;Ⅲ、根据表中数据,设此时100g水中最多能溶解硝酸钾的质量为
;Ⅲ、根据表中数据,设此时100g水中最多能溶解硝酸钾的质量为![]() ,
, ![]() ,解得
,解得![]() =110.0g,所以60.0g水能够溶解66.0g KNO3的温度范围是:t≥60℃;Ⅳ、由于硝酸钾的溶解度受温度的影响比较大,氯化钠的溶解度随温度的影响不大,可以采用冷却热饱和溶液的方法进行提纯,所以固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为:溶解、蒸发浓缩、冷却热饱和溶液、过滤(洗涤)、烘干;Ⅴ、气体的溶解度随着压强的增大而增大,随着温度的升高而降低,所以P1<P2 。
=110.0g,所以60.0g水能够溶解66.0g KNO3的温度范围是:t≥60℃;Ⅳ、由于硝酸钾的溶解度受温度的影响比较大,氯化钠的溶解度随温度的影响不大,可以采用冷却热饱和溶液的方法进行提纯,所以固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为:溶解、蒸发浓缩、冷却热饱和溶液、过滤(洗涤)、烘干;Ⅴ、气体的溶解度随着压强的增大而增大,随着温度的升高而降低,所以P1<P2 。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】水是生命的源泉,也是不可缺少的资源。
(1)某矿泉水的主要矿物质成分及含量如下表:
成分 | Ca | K | Zn | F |
含量(mg/L) | 20 | 3 | 0.06 | 0.02 |
这里Ca、K、Zn、F是指________ (填“单质、元素、分子或原子”)。
(2)水污染日益严重,水资源的保护和合理利用已受到人们的普遍关注。请参与讨论下列有关问题:
(Ⅰ)自来水、蒸馏水、海水中属于纯净物的是___________。
(Ⅱ)某学校饮水处可以将自来水净化为饮用水,其中处理步骤如下图所示:

①对应的作用是_________(填字母序号,下同),③对应的作用是_______。
A. 杀菌消毒 B.吸附杂质 C.沉淀过滤 D.蒸馏
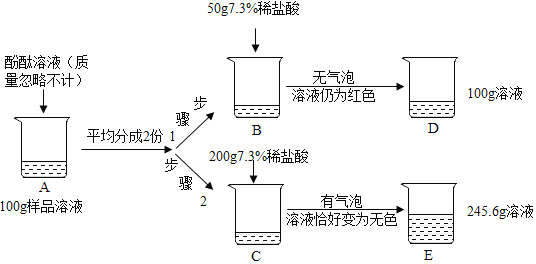
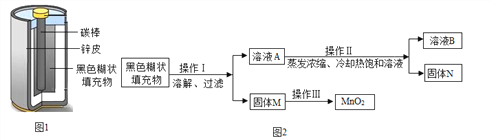
【题目】某校实验小组取酸性锌锰干电池进行探究,他们发现电池内部结构如图1所示。
【查阅资料】
⑴锌皮为金属锌(含有少量的铁)
⑵黑色糊状填充物由炭黑、MnO2、ZnC12和NH4Cl等组成
⑶有关数据见下表
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 | |
【实验探究一】小明取适量黑色糊状填充物,按图2所示实验流程进行探究。
⑴溶液A中溶质主要有ZnC12和NH4Cl,操作Ⅱ中采用冷却热饱和溶液的方法实现两者分离的依据是______________________;
⑵欲从固体M 中得到较纯的MnO2,操作Ⅲ可采用的简便方法是_________。
【实验探究二】小明取电池外壳锌皮,用砂纸打磨干净,剪成小块,进行实验。
⑴取一块锌皮放入盛有适量稀盐酸的烧杯中, 实验中可观察到的现象是_____________有关反应的化学方程式___________________________。
⑵下列各组物质混合后,也能生成ZnCl2的有_______(填字母序号)。
A. ZnO与稀盐酸 B. Zn与NaCl溶液 C. Zn(NO3)2溶液与NH4Cl溶液