题目内容
【题目】为测定某敞口放置的氢氧化钠溶液的变质情况,某同学实验并记录如图:
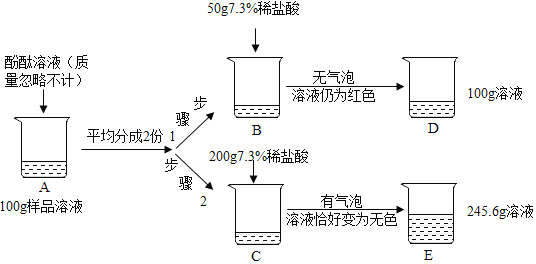
![]() 配制实验步骤1所用的稀盐酸,需要质量分数为
配制实验步骤1所用的稀盐酸,需要质量分数为![]() 的浓盐酸的质量是______;
的浓盐酸的质量是______;
![]() 烧杯中发生反应的化学方程式为______;
烧杯中发生反应的化学方程式为______;
![]() 根据已知条件求样品溶液中碳酸钠质量是多少?_________
根据已知条件求样品溶液中碳酸钠质量是多少?_________
![]() 根据计算得知D烧杯溶液中溶质的化学式为______.
根据计算得知D烧杯溶液中溶质的化学式为______.
【答案】 10g ![]() 10.6g NaCl、
10.6g NaCl、![]() 、NaOH
、NaOH
【解析】(1)根据溶液稀释前后溶质质量不变进行分析; (2)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳进行分析;(3)根据质量守恒定律计算生成二氧化碳的质量,依据化学方程式计算参加反应的碳酸钠的质量进行计算;(4)根据(3)计算出碳酸钠的质量,然后计算步骤1中加入的盐酸与氢氧化钠、碳酸钠的反应情况进行分析。(1)需要质量分数为36.5%的浓盐酸的质量是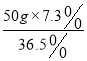 =10g;(2)B烧杯中加入盐酸后无气泡产生,溶液仍然是红色,所以发生的反应是氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为HCl+NaOH=NaCl+H2O;(3)生成二氧化碳的质量为50g+200g-245.6g=4.4g;
=10g;(2)B烧杯中加入盐酸后无气泡产生,溶液仍然是红色,所以发生的反应是氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为HCl+NaOH=NaCl+H2O;(3)生成二氧化碳的质量为50g+200g-245.6g=4.4g;
设C烧杯溶液中碳酸钠质量为x,消耗氯化氢的质量为y 。
Na2CO3 + 2HCl =2NaCl + H2O + CO2↑
106 73 44
x y 4.4g
![]()
x=10.6g
y=7.3g
与碳酸钠反应的稀盐酸的质量为![]() =100g;
=100g;
(4)与氢氧化钠反应的稀盐酸的质量为200g-100g=100g,所以步骤1中加入的50g稀盐酸没有反应完氢氧化钠,所以D烧杯溶液中溶质的化学式为NaCl、NaOH、Na2CO3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】水是我们熟悉的物质。
①为了测定水的组成,进行如下探究:
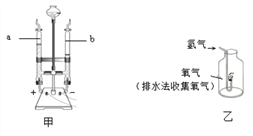
甲方案:电解水时玻璃管内的现象是____________;b管内生成的气体是______________;检验a管内产生气体的方法是___________。生成气体的体积比是___________,该实验说明水是由氢、氧元素组成的理论依据是__________;
电解水时,常加入少量氢氧化钠使电解水反应容易进行,而氢氧化钠本身的质量和化学性质不发生变化。若水电解装置中盛有一定量的氢氧化钠溶液,通电一段时间后,产生了16g氧气,管内溶液中氢氧化钠的质量分数由 2.7%变为3.0%。试计算
Ⅰ.参加反应的水的物质的量____________mol(根据化学方程式列式计算)。
Ⅱ.电解前氢氧化钠溶液的质量为________________g。
乙方案:该方案的实验目的是____________________,氢气在氧气中燃烧,反应的化学方程式是_________________,现象__________;该实验能否达到实验目的,并阐述理由___________。
②下表是KNO3 、NaCl在不同温度下的部分溶解度数据。
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32.0 | 45.8 | 64.0 | 85.5 | 110.0 | 138.0 | 169.0 | 202.0 | 246.0 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
Ⅰ. 以上两种物质溶解度的变化受温度影响较小的是___________。
Ⅱ. 在40℃时,将40gKNO3溶解在50g水中,形成溶液的质量是_______g。若升温至60℃,形成的溶液为________(填“饱和”或“不饱和”)溶液,该溶液的溶质质量分数为_______。
Ⅲ.根据表中数据,找出60.0g水能够溶解66.0g KNO3的温度范围是___________。
Ⅳ. 固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为________。
Ⅴ.气体在水中的溶解度也有一定的变化规律。下图为不同温度下,某气体的溶解度与温度的关系。
图中P1与P2表示气压,则P1与P2的关系是________。
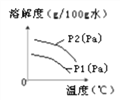
A.P1>P2
B.P1=P2
C.P1<P2
D.无法确定
【题目】小亮同学对所学部分化学知识归纳如下,其中都正确的一组是![]()
A | 合金、陶瓷、橡胶属于合成材料 缺钙会导致甲状腺疾病 | B | 区别食盐与亚硝酸钠可以品尝 区别羊毛线与棉线可以灼烧闻气味 |
C | 电动车充电是电能转化为化学能 用铁矿石炼铁时尾气要净化处理 | D | 用汽油洗涤油污是乳化作用 用氮气作粮食瓜果的保护气 |
A. A B. B C. C D. D
【题目】化学与生活密切相关。
①下图是营养药品的部分说明。说明中的“铁”指的是________(填“单质”、“元素”或“分子”);丙酸钠是由________种元素组成。1molC3H5OxNa中含有______个碳原子;该化合物中碳元素与氧元素的质量比为9∶8则x=_________。
营养成分 | 每片含量 | 每100g含量 |
铁Fe | 6.70mg | 1.12g |
丙酸钠C3H5OxNa | 0.23mg | 45.50mg |
②变色眼镜的玻璃里加入了溴化银(AgBr)和氧化铜。在强光照射下,溴化银分解成溴和银,玻璃颜色变深,此属于_________反应(填“化合反应”或“分解反应”);当光线变暗时,溴和银在氧化铜作用下,重新生成溴化银,玻璃颜色变浅,而氧化铜在变化前后质量和化学性质没有变化,则氧化铜在反应中起_________作用。眼镜的铜螺丝部位常出现一层绿色物质,这是由于铜生锈的原因:请完成该反应的化学方程式:2Cu+O2+__________+H2O=Cu2(OH)2CO3